- سپهرگاز کاویان تولید کننده و تامین کننده انواع گازهای خالص و ترکیبی
- دارای گواهینامه iso17025
- تهران,کیلومتر 20 جاده قدیم کرج
- 021-46837072
گاز هیدروژن
- خانه
- گاز هیدروژن
گاز هیدروژن، گازی بیرنگ، بیبو و بدون مزه است که بیشترین فراوانی را در بین عناصر روی زمین دارد. این عنصر از نظر جرم اتمی به عنوان سبکترین عنصر شناخته میشود که اتم آن شامل یک پروتون و یک الکترون و فاقد نوترون است. این عنصر را میتوان در همهجا پیدا کرد. در آب، چربیها، نفت خام، هیدروکربنها، اسیدهای چرب، کربوکسیلیک اسیدها، شکر، آمونیاک، هیدروژن پراکسید و بسیاری از مواد دیگر، ردی از هیدروژن یافت میشود.
هیدروژن (۱H بهطور طبیعی دارای ۳ ایزوتوپ است که گاهی به صورت ۲H, ۱H, و ۳H نشان داده می شوند. دوتای اولی (یعنی ۲H, ۱H) پایدار هستند , درحالی که ۳H دارای نیمه-عمر ۱۲.۳۲ سال است. همچنین از هیدروژن ایزوتوپ های سنگین تری نیز وجود دارند که همگی مصنوعی (سنتزی) هستند، و نیمه-عمر آن ها کمتر از یک زپتوثانیه (۱۰−۲۱ ثانیه) است، از این میان، ۵H پایدارترین و، ۷H کمترین پایداری را دارد.
گاز هیدروژن تنها عنصری است که ایزوتوپ های آن نام های متفاوتی به صورت عامیانه دارند: ایزوتوپ ۲H (یا هیدروژن-۲) معادل دوتریوم و ایزوتوپ ۳H (یا هیدروژن-۳) معادل تریتیوم است.
گاز هیدروژن آزمایشگاهی
هیدروژن یا آبزا (به انگلیسی: Hydrogen)، با نماد شیمیایی H نام یک عنصر شیمیایی در جدول تناوبی با عدد اتمی ۱ است. جرم اتمی این عنصر ۱٫۰۰۷۹۴ u است. هیدروژن سبکترین عنصر در جهان است و بیش از دیگر عنصرها میتوان آن را به صورت آزاد در طبیعت پیدا کرد. میتوان گفت نزدیک به ۷۵٪ از جرم جهان از هیدروژن ساخته شدهاست. برخی جرمهای آسمانی مانند کوتولهٔ سفید یا ستارههای نوترونی از حالت پلاسمای هیدروژن ساخته شدهاند؛ ولی در طبیعت روی زمین به سختی میتوان تک اتم هیدروژن را پیدا کرد.
ایزوتوپی از هیدروژن که بیشتر دیده میشود، پروتیوم نام دارد (بیشتر از نماد آن ۱H یاد میشود تا نام آن) این ایزوتوپ، یک پروتون دارد و نوترون ندارد و در ترکیبهای یونی میتواند بار منفی (آنیون هیدرید با نماد -H) به خود بگیرد. همچنین بار مثبت آن نیز به صورت +H یافت میشود که در این صورت تنها از یک پروتون ساده ساخته شدهاست. البته در حقیقت بدست آوردن کاتیون هیدروژن در ترکیبهای پیچیده تری ممکن میشود.
بیشتر بخوانید: گاز آرگون را از کجا تهیه کنیم
عنصر هیدروژن با بیشتر عنصرها میتواند ترکیب شود و میتوان آن را در آب، تمامی ترکیبهای آلی و موجودات زنده پیدا کرد. این عنصر در واکنشهای اسید و قلیایی در بسیاری واکنشها با داد و ستد پروتون میان مادهٔ حل شدنی و حلال نقش مهمی از خود نشان میدهد. گاز هیدروژن به عنوان سادهترین عنصر شناخته شده در دانش نظری بسیار کمککار بودهاست، برای نمونه از آن در حل معادلهٔ شرودینگر یا در مطالعهٔ انرژی و پیوند و در نهایت پیشرفت دانش مکانیک کوانتوم نقش کلیدی داشتهاست.
گاز هیدروژن (با نماد H۲) نخستین بار در سدهٔ ۱۸ میلادی به صورت آزمایشگاهی از واکنش اسیدهای قوی با فلزهایی مانند روی بدست آمد (۱۷۶۶ تا ۱۷۸۱). هنری کاوندیش نخستین کسی بود که دریافت گاز هیدروژن برای خود، یک مادهٔ جداگانهاست. و از سوختن آن آب پدید میآید. دلیل نامگذاری هیدروژن هم همین ویژگی آن است به معنی آبساز در زبان یونانی. در شرایط استاندارد دما و فشار هیدروژن عنصری است بیرنگ، بیبو، بیمزه، نافلز، غیرسمّی یک ظرفیتی، گازی دو اتمی، بسیار آتشگیر و با فرمول شیمیایی H۲.
در صنعت برای تولید گاز هیدروژن از گاز طبیعی بهره میبرند و کمتر به الکترولیز آب روی میآورند. بیشتر هیدروژن تولیدی در نزدیکی محل تولید، در فرایند سوخت سنگوارهای (مانند کراکینگ) و تولید آمونیاک برای ساخت کود شیمیایی، مورد بهرهبرداری قرار میگیرد. امروزه دانشمندان در تلاش اند تا جلبکهای سبز را در تولید هیدروژن بکار ببندند.
در دانش فلزشناسی، تردی هیدروژنی بسیاری فلزها مورد بررسی است تا با کمک آن در طراحی لولهها و مخزنها دگرگونیهایی پدیدآورند.
آشنایی بیشتر با هیدروژن
اگر هیدروژن با هوا آمیخته شود و غلظت آن میان ۴ تا ۷۴ درصد باشد یا آمیزهای از هیدروژن و کلر با درصد ۵ تا ۹۵ درصد میتواند مادهای انفجاری را پدیدآورد. این آمیزههای گازی با یک جرقه، کمی گرما یا نور خورشید بیدرنگ منفجر میشود.
دمای خود آتشگیری هیدروژن، دمایی که این گاز خود به خود در هوا آتش میگیرد، ۵۰۰ درجهٔ سانتیگراد یا ۹۳۲ فارنهایت است.
از شعلهٔ سوختن هیدروژن-اکسیژن خالص پرتوهای فرابنفش تابیده میشود که برای چشم ناپیدایند. مانند شعلهای که در موتور اصلی شاتل فضایی در اثر سوختن هیدروژن-اکسیژن پدید میآید.
بیشتر بخوانید| گاز پروپان چیست
برای ردیابی نشتی در هیدروژن در حال سوختن نیاز به ابزارهای ردیابی شعله داریم، چنین نشتیهایی میتوانند بسیار خطرناک باشند. فاجعهٔ آتشگیری کشتی هوایی هیندنبرگ و سقوط آن یک نمونهٔ مصیبتبار از سوختن هیدروژن است دلیل این آتشسوزی مورد بررسی است اما شعله و آتشی که از بیرون دیده شد به دلیل سوختن دیگر مواد روی این کشتی هوایی بود. چون گاز هیدروژن سبک است و در هوا شناور میشود شعلهٔ آتش هیدروژن خیلی زود بالا رفت و نسبت به سوختهای هیدروکربنی خرابی کمتری به بار آورد. دو-سوم سرنشینان این فضاپیما از آتشسوزی جان سالم به در بردند. بیشتر کشتهها به دلیل سقوط یا آتشگیری سوخت دیزل بود.
الکترولیز آب هم یک روش آسان برای تولید گاز هیدروژن است. با گذر یک جریان کم ولتاژ از آب میتوان گاز اکسیژن را در آنُد و گاز هیدروژن را در کاتُد جمع کرد. برای جمعآوری هیدروژن معمولاً کاتد از پلاتین یا یک فلز واسطهٔ دیگر برگزیده میشود. البته چون امکان آتش گرفتن وجود دارد و اکسیژن هم به این سوختن کمک میکند برای همین فلز کاتد و آند هر دو واسطه در نظر گرفته میشود (آهن اکسید میشود و مقدار اکسیژن بدست آمده را کاهش میدهد). بیشترین بازده نظری این واکنش یعنی نسبت جریان الکتریسیته به هیدروژن تولیدی میان ۸۰ تا ۹۴ درصد است.
گاز هیدروژن چیست؟
در سال 1671، رابرت بویل واکنش بین خردههای آهن و اسید رقیق را به طور کامل تشریح کرد که موجب تولید گاز هیدروژن بود. در بین سالهای 1766 تا 1781، «هنری کاوندیش» (Henry Cavendish)، اولین کسی بود که متوجه شد گاز هیدروژن یک ماده مجزا است و به هنگام سوختن، آب تولید میکند. او آن را «هوای قابل اشتعال» (Flammable Air) نامید. آنتوان لاوازیه نام هیدروژن را برای این عنصر انتخاب کرد که از ریشه یونانی آن شامل واژههای (Hydro) به معنی آب و (Genes) به معنای خالق گرفته شده است.
تاریخچه کشف گاز هیدروژن
گاز هیدروژن یکی از جالب ترین عناصر جدول تناوبی است عدد اتمی اش یک و سبک ترین گاز موجود در طبیعت است عنصری است که برای حل بسیاری از مسائل شیمی نظری کشفش ضروری بوده عنصری است که با از دست دادن تنها الکترونش تبدیل به پروتونی عریان و بدون پوشش می شود و بنابراین شیمی هیدروژن شیمی ویژه ای است و در واقع شیمی یکی از ذرات اساسی است.
مندلیف هیدروژن را عادی ترین عنصر درمیان عناصر عادی می نامد (وی عناصر موجود در تناوبهای کوتاه جدول تناوبی را عادی تلقی می کرد) زیرا این عنصر آغازگر سری عناصر شیمیایی طبیعی بود می توان با واکنش ساده مانند ریختن اسید کلریدریک بر روی براده ی روی مقداری گاز هیدروژن تهیه کرد.
حتی در دورانهای کهن که هنوز شیمی به عنوان علم تلقی نمیشد و کیمیا گران در جستجوی کیمیا بودند اسید کلریدریک، اسید سولفوریک،اسید نیتریک،آهن وروی ، شناخته شده بودند به عبارت دیگر بشر کلیه موادی را که با اثردادنشان بر هم می توانست هیدروژن تهیه کند در اختیار داشت . تنها برای شناختن آن می بایستی واقعه ای رخ دهد .
در نوشتههای قرنهای دهم تا دوازدهم شمسی / شانزدهم تا هیجدم میلادی گزارشهایی موجود است که نشان می دهد در برخی موارد مانند ریختن اسیدسولفوریک بر روی براده آهن گازی متساعد می شده است که در آن زمان تصور می شد که نوعی هوای قابل اشتعال است . یکی از کسانی که به این نوع هوای اسرار آمیز برخورده است لومونوزوف دانشمند مشهور روسی بوده است . در سال ۱۱۲۴/ ۱۷۴۵ وی رساله ای تحت عنوان « درباره درخشندگی فلزی» نوشت که از جمله مطالبش یکی این بود که :« با حل کردن برخی فلزات پست ، به ویژه آهن ، در الکل اسیدی شده ،بخارات قابل اشتعال از دهانه باز دستگاه آزمایش خارج می شود …. (بنابر اصطلاحات متداول آن زمان ، اسید را الکل اسیدی شده می نامند ) بنابراین ، آنچه که لومونوزوف دیده بود چیزی جز هیدروژن نبوده است . ولی اگر جمله اش را تا آخر بخوانیم ، می بینم که نوشته است … این بخارات فلوژیستون است . نظر به اینکه انحلال فلز در اسید موجب تولید materia ignea یا بخاری قابل اشتعال می شد ، خیلی مناسب بود که آن را به اینگونه تفسیر کنند که انحلال فلز ، سبب آزاد شدن فلوژیستون می شود .
با این عبارت پردازی ، واکنش مزبور منطبق بر « نظریه آتش زایی » می شود . اینک به جا است که با کاوندیش دانشمند ارزنده انگلیسی آشنا شویم وی با تعصب عجیبی به علم گرایش داشت و آزمایشگر برجسته ای بود . وی هرگز در انتشار نتایج تجربه هایش عجله نداشت و گاه سالها می گذشت تا مطلبی منتشر کند بنابراین مشکل است بتوان به طور دقیق معلوم کرد که وی آزاد شدن « هوای قابل اشتعال» را در چه تاریخ مشاهده کرده است .
نکته ای که در این مورد معلوم است ، انتشار مطلبی در سال ۱۱۴۵ شمسی / ۱۷۶۶ میلادی تحت عنوان «آزمایشهایی با هوایی مصنوعی» بود که یکی از موضوعات اساسی را در پژوهش های شیمی هوایی تشکیل داد . در عین حال به نظر می رسد که آن تجربیات بر اثر پافشاری بلاک انجام شده باشد . « هوای ثابت » توجه کاوندیش را جلب کرده بود و در نتیجه وی تصمیم گرفته بود ببیند آیا نوع دیگری از هوای مصنوعی وجود دارد یا خیر .
در این بررسیها او اشاره به نوع دیگری از هوا می کرد که در ترکیبات وجود دارد و به طور مصنوعی قابل جدا کردن از آنها است . ولی می دانست که هوای قابل اشتعال را درموارد متعدد دیده اند و خودش هم به همان روش یعنی اثر دادن اسید سولفوریک و اسید کلرئیدریک بر آهن ، روی و قلع ، به تهیه آن مبادرت ورزید . با انجام این آزمایشها ،وی نخستین فردی بود که ثابت کرد که در همه موارد یاد شده نوع مشابهی هوا یعنی «هوای قابل اشتعال » را مورد توجه قرار می گیرد . کاوندیش به عنوان پیرو «نظریه آتش زایی » تنها به یک نوع تفسیر در باره طبیعت ماده اعتقاد داشت . بنابراین او هم مانند لومونوزوف، این ماده را فلوژیستون نامید .
برای استعلام قیمت و خرید گاز سولفورهگزا فلورید کلیک کنید
وقتی وی درباره خواص «هوای قابل اشتعال » بررسی می کرد ، مطمئن بود که مشغول بررسی خواص «فلوژیستون » است . او ضمن کارهایش به این نتیجه رسیده بود که فلزات مختلف ، حاوی نسبت های مختلفی از «هوای قابل اشتعال » هستند.
بنابراین به «هوای ثابت »مورد اداعای بلاک ، «هوای قابل اشتعال » کاوندیش هم اضافه شد . به طور خلاصه آن دو دانشمند چیز تازه ای کشف نکرده اند و فقط توانستند مشاهدات گذشتگان را جمع بندی کنند . اما همین جمع بندیها سبب پیشرفت چشمگیری در تاریخ دانش بشری شد .
«هوای ثابت » و «هوای قابل اشتعال» با یکدیگر و با هوای معمولی تفاوت داشتند.«هوای قابل اشتعال » به طور اعجاب آور سبک وزن بود .کاوندیش متوجه شد که فلوژیستونی که به دست آورده است ، دارای جرم است. وی نخستین فردی بود که کمیت چگالی را برای اندازه گیریهای مربوط به گازها معرفی کرد . وقتی چگالی هوا را برابر واحد فرض کرد ، برای چگالی «هوای قابل اشتعال» مقدار ۹./. و برای چگالی «هوای ثابت » مقدار ۷۵/۱ بدست آورد . اما در اینجا میان کاوندیش تجربه گر و کاوندیش طرفدار «نظریه آتش زایی» اختلاف بروز کرد زیرا با توجه به این که «هوای قابل اشتعال » دارای جرم است ،به همین وجه نمی توان آن را فلوژیستون خالص تلقی کرد .
به عبارت دیگر فلزاتی که هوای قابل اشتعال را از دست می دهند ، اجبارا باید دستخوش کم شدن جرم هم بشوند کاوندیش برای رفع این تناقض ، فرضیه ای بی محتوا به این شرح ابراز داشت :«هوای قابل اشتعال » مجموعه ای از فلوژیستون و آب است . حاصل آن فرضیه این بود که بلاخره در ترکیب «هوای قابل اشتعال » هیدروژن ظاهر شد .
نتیجه آشکار این است که گر چه کاوندیش «هوای قابل اشتعال »را وزن کرد ، خواصش را شرح داد و آن را نوع ویژه ای از «هوای مصنوعی » دانست ،ولی او هم مانند پیشینیانش به ماهیت این ماده پی نبرد . به عبارت دیگر کاوندیش بدون آگاهی از واقیعت ماده ای را که به دست آورده بود به عنوان فلوژیستون مورد مطالعه قرار داد ، نه به عنوان عنصر شیمیایی جدید و علت این اشتباه ، پایبند بودنش به «نظریه آتش زایی » بود . وقتی وی متوجه شد که خواص «هوای قابل اشتعال » مغایر با آن نظریه است «فرضیه ای که به اندازه نظریه گفته شده گمراه کننده بود ، ارائه داد.
بنابراین اگر بگوییم «هیدروژن را کاوندیش دانشمند انگلیسی در سال ۱۱۴۵ /۱۷۶۶ کشف کرده است» ، حرف نادرستی زده ایم . درمقایسه با دیگران ، کاوندیش روشهای تهیه و نیز خواص « هوای قابل اشتعال » را با جزئیات بیشتری شرح داده است . در هر حال ولی در عین حال نمی دانست چه کار می کند و طبیعت عنصری هوای قابل اشتعال بر او روشن نشده بود . ولی نمی توان گناه را به گردن این دانشمند گذاشت ، بلکه باید گفت که شیمی هنوز به آن درجه از کمال که چنین پیش بینی هایی داشته باشد ،نرسیده بود . سالها گذشت تا سرانجام هیدروژن واقعا هیدروژن شد و جای شایسته اش را در شیمی اشغال کرد نام لاتین آن hydrogenium از دو کلمه یونانی hydro وgennac به معنی « آب زا » گرفته شده است .
این نام را لاووازیه درسال ۱۱۵۸ / ۱۷۷۹ پس از معلوم شدن ترکیب آب ،پیشنهاد کرد . حرفH به عنوان علامت شیمیاییش توسط برزلیوس پیشنهاد شده است . گاز هیدروژن از جهت اینکه ایزوتوپهایش هم از نظر خواص فیزیکی با هم متفاوتند و هم از نظر خواص شیمیایی ، عنصری منحصر به فرد است . زمانی این تفاوت ها برخی دانشمندان را واداشت که ایزوتوپهای هیدوژن را به عنوان عناصر جداگانه ای تلقی کنند و برایشان جای ویژه ای در جدول تناوبی پیدا کنند .بنابراین تاریخچه کشف ایزوتوپهای هیدروژن همانند تاریخچه خود هیدروژن جالب توجه است .
جستجوی ایزوتوپهای هیدروژن در دهه اول قرن حاضر شمسی /دهه سوم قرن حاضر میلادی آغاز شد ولی همه کوششها ناکام ماند و نتیجه گیری کردند که هیدروژن ایزوتوپ ندارد . در سال ۱۳۱۰/ ۱۹۳۱ پیشنهاد شد که هیدروژن باید دارای ایزوتوپی به عدد جرمی ۲ باشد . نظر به اینکه چنین ایزوتوپی جرمش دو برابر هیدروژن است ، دانشمندان برای جدا کردن هیدروژن سنگین به روشهای فیزیکی متوسل شدند. در سال ۱۳۱۱ /۱۹۳۲ سه نفر دانشمند آمریکایی به نامهای یوری ، بریکود و مورفی هیدروژن مایع را تبخیر کردند و با مطالعه باقی مانده تبخیر به روش طیف سنجی ،ایزوتوپ سنگین را در آن یافتند .
وجود هیدروژن سنگین در هوای جو در سال ۱۳۲۰/۱۹۴۱محقق شد.نام دوتریوم deuterium از کلمه یونانی deuteron به معنی «دومین یا یکی دیگر » گرفته شده است . ایزتوپ دیگر با عدد جرمی سه به نام تریتیوم( مشتق از کلمه یونانی tritos به معنی سومین ) رادیواکتیو است و در سال ۱۳۱۳ /۱۹۳۴ توسط سه دانشمند انگلیسی به نامهای اولیفانت ،هارتک و رادرفوردشناخته شده است . به ایزوتوپ اصلی هیدروژن نام پروسیوم نیز داده اند .این تنها موردی است که ایزوتوپهای یک عنصر نامها و علامتهای شیمیایی متفاوت دارند (hوt و d).۹۹/۹۹ درصد همه هیدروژنها از پروسیوم است و بقیه اش دوتریوم می باشد.
کاربرد ایزوتوپ های هیدروژن
گاز هیدروژن تنها عنصری است که ایزوتوپ های آن نام های متفاوتی به صورت عامیانه دارند: ایزوتوپ ۲H (یا هیدروژن-۲) معادل دوتریوم ایزوتوپ ۳H (یا هیدروژن-۳) معادل تریتیوم است.نمادهای D و T گاهی اوقات برای اشاره به دوتریوم و تریتیوم استفاده میشوند. آیوپاک نمادهای D و T را قبول کرده است، اما پیشنهاد کرده است که به جای آن از “نمادهای استاندارد” (۲H و ۳H) استفاده شود، به جهت جلوگیری از سردرگمی در طبقه بندی حروف در فرمول شیمیایی. هیدروژن معمولی بدون نوترون گاهی، پروتیوم نامیده میشود. (در طول مطالعات اولیه رادیواکتیو به برخی از ایزوتوپ های رادیواکتیو سنگین نام های دیگری داده شد، اما چنین نام هایی امروزه به ندرت مورد استفاده قرار می گیرد.)
ایزوتوپ اتمهایی هستند که یکساناند، به این معنی که تعداد پروتونهای یکسانی دارند، اما تعداد نوترونهای متفاوتی دارند. ایزوتوپها در جدول تناوبی به ترتیب افزایش عدد اتمی فهرست شدهاند، اما جرم اتمی آنها ممکن است متفاوت باشد. به عنوان مثال، هیدروژن سه ایزوتوپ دارد: هیدروژن معمولی، دوتریوم و تریتیوم. هیدروژن معمولی تنها یک پروتون و هیچ نوترونی دارد. دوتریوم یک پروتون و یک نوترون دارد. تریتیوم یک پروتون و دو نوترون دارد.
ایزوتوپها میتوانند پایدار یا ناپایدار باشند. ایزوتوپهای پایدار ایزوتوپهایی هستند که به طور طبیعی یافت میشوند و تجزیه نمیشوند. ایزوتوپهای ناپایدار ایزوتوپهایی هستند که تجزیه میشوند و به ایزوتوپهای دیگر تبدیل میشوند.
ایزوتوپها در بسیاری از زمینهها از جمله پزشکی، کشاورزی و صنعت استفاده میشوند. در پزشکی، از ایزوتوپها برای تشخیص و درمان بیماریها استفاده میشود. در کشاورزی، از ایزوتوپها برای بهبود عملکرد محصولات کشاورزی استفاده میشود. در صنعت، از ایزوتوپها برای تولید مواد جدید و بهبود فرآیندهای صنعتی استفاده میشود.
ایزوتوپها ابزار قدرتمندی هستند که در بسیاری از زمینهها استفاده میشوند. آنها به ما کمک میکنند تا درک بهتری از جهان اطرافمان داشته باشیم و آن را به مکانی بهتر تبدیل کنیم.
خواص شیمیایی و فیزیکی گاز هیدروژن
گاز هیدروژن، گازی بیرنگ، بیبو و بدون مزه است که بیشترین فراوانی را در بین عناصر روی زمین دارد. این عنصر از نظر جرم اتمی به عنوان سبکترین عنصر شناخته میشود که اتم آن شامل یک پروتون و یک الکترون و فاقد نوترون است. این عنصر را میتوان در همهجا پیدا کرد. در آب، چربیها، نفت خام، هیدروکربنها، اسیدهای چرب، کربوکسیلیک اسیدها، شکر، آمونیاک، هیدروژن پراکسید و بسیاری از مواد دیگر، ردی از هیدروژن یافت میشود.
گاز هیدروژن سبک ترین عنصر شیمیایی با معمولترین ایزوتوپ آن است که شامل تنها یک پروتون و الکترون است. در شرایط فشار و دمای استاندارد هیدروژن یک گاز ، H2 ، دو اتمی با نقطه جوش 20.27K و نقطه ذوب 14.02K را میسازد. در صورتیکه این گاز تحت فشار فوقالعاده بالایی ، مانند شرایطی که در مرکز غولهای گازی وجود دارد، قرار گیرد، مولکولها ماهیت خود را از دست داده و هیدروژن بصورت فلزی مایع در میآید.
واکنش هیدروژن با فلزات واسطه
واکنش گاز هیدروژن با عناصر (فلزات) واسطه سبب تولید هیدریدهای فلزی میشود. هیچ نسبت ثابتی از اتمهای هیدروژن نسبت به این فلزات وجود ندارد چرا که در حقیقت، اتمهای هیدروژن حفرات بین ساختار بلوری این فلزات را پر میکنند.
کاربرد گاز هیدروژن
قسمت اعظمی از هیدروژنی که امروزه به طور صنعتی به تولید میرسد، حاصل فرآوری گاز متان با بخار یا تولید «گاز آب» (Water Gas) از واکنش زغالسنگ با بخار است. بیشتر گاز هیدروژن تولیدی در فرآیند هابر برای تولید آمونیاک به مصرف میرسد.
هیدروژناسیون
همچنین از این عنصر برای «هیدروژناسیون» (Hydrogenation) روغنهای گیاهی استفاده میشود تا آنها را از حالت مایع به جامد تبدیل کنند مانند کره مارگارین. علاوه بر این، از هیدروژن مایع در سوخت موشکها نیز بهره میگیرند زیرا همانطور که اشاره شد، ترکیب هیدروژن و اکسیژن انرژی بسیار زیادی تولید میکند. علاوه بر این، از آنجایی که هیدروژن کاهنده مناسبی است، از آن برای تولید فلزاتی همچون آهن، مس، نیکل و کبالت نیز استفاده میکنند.
کشتی هوایی
یک متر مکعب از گاز هیدروژن میتواند تا بیش از 300 گرم از یک ماده را از روی زمین بلند کند که این امر استفاده از کشتیهای هوایی را در اوایل قرن 19 رونق داد. البته استفاده از این گاز در طول جنگ جهانی دوم منسوخ شد چراکه در مواردی سبب انفجارهای شدید شده بود. بعد از وقایع جنگ جهانی و انفجارهای حاصل از این گاز، تصمیم بر آن شد تا از گازهای نجیب همانند هلیوم استفاده شود.
جایگزین سوخت فسیلی
با توجه به لزوم پیدا کردن جایگزین مناسب برای سوختهای فسیلی، در دهههای اخیر تحقیقاتی به همین منظور در خصوص این عنصر صورت گرفته است تا بتوان آن را به عنوان منبعی برای انرژی در نظر گرفت. به علت انرژی زیادی که در هیدروژن مایع و گاز فشرده هیدروژن وجود دارد، استفاده از آنها به عنوان سوخت آینده دور از ذهن نیست. از نکات مثبت این سوخت میتوان به پاک بودن آن اشاره کرد زیرا با سوختن آن، تنها آب تولید میشود. البته این کار با فناوریهای امروزی بسیار پرهزینه خواهد بود.
خودروهایی با سوخت گاز هیدروژن
احتراق سوختها انرژی زیادی تولید میکند که میتوان آن را با چرخش یک توربین به انرژی الکتریکی تبدیل کرد. البته این کار بازده پایینی دارد زیرا انرژی زیادی به صورت گرما از دست میرود. تولید الکتریسیته از طریق سلولهای ولتایی، بازده بیشتری دارد. سلولهای ولتایی که انرژی شیمیایی را به انرژی الکتریکی تبدیل میکنند موسوم به «پیل سوختی» (Fuel Cell) هستند. از آنجایی که این پیلها به طور خودکار عمل نمیکنند، نمیتوان آنها را به عنوان یک باتری در نظر گرفت.
سلو لهای هیدروژنی
سلول هیدروژنی نوعی از پیل سوختی است که در آن، واکنش بین خیدروژن و اکسیژن موجب تشکیل آب میشود و بازدهی آن بیش از دو برابر بازده بهترین موتور درونسوز است. در سلول و تحت شرایط بازی، اکسیژن در کاتد کاهش پیدا میکند و در همین زمان گاز هیدروژن در آند اکسید میشود. البته استفاده از این فناوری بسیار پرهزینه است و نمیتوان از آن در زندگی روزمره استفاده کرد.
- واکنش کاهش:
O2(g)+2H2O(l)+4e–→4OH–(aq)
- وکنش اکسایش:
H2(g)+2OH–(aq)→2H2O(l)+2e–
- واکنش کلی:
2H2(g)+O2(g)→2H2O(I)
بیشتر بخوانید | کاربرد گاز هیدروژن در فولادسازی
کاربردهای دیگر گاز هیدروژن
در حال حاضر گاز هیدروژن کاربردهای بسیاری فراوانی از جمله:
در صنایع شیمیایی
پالایشگاه ها
متالوژی
شیشه
الکترونیک
به عنوان سوخت در کاربردهای فضایی
مصارف صنعتی بسیار گوناگون و متفاوت
دارد. هیدروژن در درجه اول به عنوان یک ماده ی واکنش دهنده مورد استفاده قرار می گیرد.
برخی گاز هیدروژن را سوخت تمیز آینده می دانند – تولید شده از آب و هنگام اکسید شدن به آب برمی گردد. پیل های سوختی مجهز به هیدروژن به طور فزاینده ای به عنوان منابع انرژی “عاری از آلودگی" دیده می شوند و اکنون در برخی از اتوبوس ها و اتومبیل ها مورد استفاده قرار می گیرند.
هیدروژن همچنین کاربردهای زیادی دارد. در صنایع شیمیایی از آن برای ساختن آمونیاک برای کودهای کشاورزی (فرآیند هابر) و سیکلوهگزان و متانول استفاده می شود که واسطه های تولید پلاستیک و داروسازی هستند. همچنین در فرآیند تصفیه روغن برای حذف گوگرد از سوخت استفاده می شود. مقادیر زیادی هیدروژن برای هیدروژناسیون روغنها برای تشکیل چربیها استفاده می شود ، به عنوان مثال برای ساخت مارگارین.
در صنعت شیشه از گاز هیدروژن به عنوان جو محافظ برای ساخت ورقهای تخت شیشه استفاده می شود. در صنعت الکترونیک از آن به عنوان گاز شستشو در هنگام تولید تراشه های سیلیکون استفاده می شود.
تراکم کم هیدروژن ، آن را به عنوان گزینه ای طبیعی برای اولین کاربرد عملی خود – پر کردن بالن و کشتی های هوایی – در آورده است. با این حال ، با اکسیژن (برای تشکیل آب) واکنش شدیدی نشان می دهد و با آتش گرفتن کشتی هوایی هنددنبورگ آینده آن در پر کردن کشتی های هوایی پایان یافت.
نقش بیولوژیکی
هیدروژن یک عنصر اساسی برای زندگی است. این ماده در آب و تقریباً در تمام مولکول های موجودات زنده وجود دارد. با این حال ، گاز هیدروژن به خودی خود نقش فعال خاصی ندارد. این ماده به اتم های کربن و اکسیژن پیوند می خورد ، در حالی که شیمی زندگی در مکان های فعال تر ، شامل اکسیژن ، نیتروژن و فسفر انجام می شود.
خاموش کردن آتش گاز هیدروژن
آتش گازهیدروژن قابل خاموش كردن نيست لذا شير محل نشتي را سريعا ببنديد. از تجهيزات ايمني مناسب استفاده كنيد. همه افراد را از محل خارج كنيد. از اسپري آب براي خنك كردن ظرف محتوي گاز هيدروژن و مخازن ديگر استفاده كنيد .از پودرخشك ، دي گازاكسيدكربن، اسپري آب، كف براي خاموش كردن اتش هاي جانبي ديگر مي توانيد استفاده كنيد
اثرات گاز هیدروژن بر سلامتی انسان
تماس گاز هیدروژن با چشم
اثر مخربي روي چشم گزارش نشده است . ولي ممكن است به سبب خروج گاز هیدروژن از مخزن تحت فشار، سرما ايجاد شود و در تماس با چشم سبب يخ زدگي و ناراحتي گردد. مصدوم بايد به فضاي باز و داراي تهويه منتفل شده و سپس به پزشك مراجعه شود.
تماس گاز هیدروژن با پوست
در تماس اين ماده با پوست تأثيرات زيانباري گزارش نشده است. در اثر سوختن گاز هیدروژن ، بخش آسيب ديده را زير آب سرد خنك كنيد ، سپس از باند استريل براي پوشاندن محل استفاده كني دچنانچه مصدوم از ناحيه صورت ، گلو ، سر و يا سينه دچار سوختگي شده باشد و در نتيجه آن ممكن است راه تنفسي مسدود شود ، بايد فرد مصدوم را فوراً به مراكز امدادسوانح وسوختگي تخصصي ببريد
بلعیدن و خوردن گاز هیدروژن
خوردن گاز هیدروژن كه در دما و فشار معمولي بصورت گاز است، امكان ندارد.
تنفس گاز هیدروژن
فرد مصدوم را به هواي آزاد ببريد درصورت ايست تنفسي به فرد اكسيژن مصنوعي داده ودرصورت ايست قلبي، عمليات احياء قلبي ريوي انجام دهيد.
در صنعت برای تولید گاز هیدروژن از گاز طبیعی بهره میبرند و کمتر به الکترولیز آب روی میآورند. بیشتر هیدروژن تولیدی در نزدیکی محل تولید، در فرایند سوخت سنگوارهای (مانند کراکینگ) وسنتز آمونیاک برای ساخت کود شیمیایی، مورد بهرهبرداری قرار میگیرد. دانشمندان امروزه در سعی دارند تا جلبکهای سبز را در تولید گاز هیدروژن بکار ببندند.
در دانش فلزشناسی، تردی هیدروژنی بسیاری فلزها را بررسی مینمایند تا با کمک آن در طراحی لولهها و مخزنها دگرگونیهایی بوجود آورند.
با توجه به الزام پیدا کردن جایگزین مناسب برای سوختهای فسیلی، در دهههای گذشته تحقیقاتی به همین منظور در خصوص این عنصر صورت گرفته است تا بتوان آن را به عنوان منبعی برای تولید انرژی در نظر گرفت. به علت انرژی زیادی که در هیدروژن مایع و گاز فشرده هیدروژن وجود دارد، استفاده از آنها به عنوان سوخت آینده ایده عجیبی به نظر نمیرسد. از نکات قابل توجه این سوخت میتوان به پاک بودن آن اشاره کرد زیرا با سوختن آن، تنها آب تولید میگردد. البته این کار با فناوریهای امروزی بسیار پرهزینه است.
اثرات گاز هیدروژن بر محیط زیست
هیدروژن که فراوانترین عنصر کائنات و دومین عنصر فراوان روی زمین است ، می تواند به عنوان سوخت در موتورهای احتراق داخلی و یا برای تولید برق در پیله ای سوختی مورد استفاده قرار گیرد .
این فرآیند پاک بوده وتنها فرآورده جنبی آن آب و اندکی اکسید نیتروژن است و تولید کربن ندارد. اما گرچه هیدروژن نسبت به سوخت های فسیلی برتری های چشمگیری دارد و جایگزینی آن با سوخت های فسیلی می تواند انتشار کمتر گازهای گلخانه ای را به همراه داشته باشد ، اما به دلیل دارا بودن ویژگی های خاص از جمله سبکی و قابلیت نفوذ زیاد ، همزمان می تواند به عنوان یک گاز گلخانه ای نیز عمل نماید. جایگزینی سوخت هیدروژن تولیدی بشر با سوخت های فسیلی ، با انتشار کمتر آلاینده ها و گازهای گلخانه ای بسته به فناوری های تولید هیدروژن ، می تواند پیشرفت های اساسی در رفع بحران جهانی انرژی و بحران جهانی زیست محیطی ایجاد نماید.
اما امکان بروز پیامدهای غیرمنتظره ناشی از نشت هیدروژن مصرفی خودروها ، تاسیسات تولید هیدروژن و شبکه حمل و نقل و توزیع و انتقال آن نیز وجود دارد.
تردیدهای اساسی در زمینه چگونگی تغییرات در انتشارات NOx و CH4 و CO2 و میزان چرخه عمر و بقای H2 و اثرات بالقوه رها شدن مقادیر قابل توجهی هیدروژن در آتمسفر وجود دارد که در صورت استفاده گسترده از هیدروژن به جای سوخت های فسیلی ، اجتناب ناپذیر خواهد بود.
هر گونه افزایش غلظت هیدروژن در آتمسفر می تواند اثراتی به همراه داشته باشد که مهمترین آنها افزایش غلظت بخار آب در آتمسفر بالاتر و سردتر شدن آن است که به طور غیر مستقیم نابودی لایه ازون را در پی دارد. افزایش انتشار هیدروژن همچنین می تواند ظرفیت اکسید کنندگی آتمسفر را کاهش داده و طول عمر آلاینده های هوا و گازهای گلخانه ای مانند متان ، هیدروکلروفلویوروکربن ها (HCFCs) و هیدروفلویوروکربن ها (HFCs) را افزایش دهد. لذا قبل از جایگزینی کامل هیدروژن با سوخت های موجود ، بررسی اثرات زیست محیطی آن ضروری به نظر می رسد.
هنگام کار بامایع و یا گاز هیدروژن باید بسیار هشیار بود. این به دلیل توان آتشگیری و انفجار آن است بویژه هنگامی که با هوا آمیخته میشود و هنگامی که خالص و یا بدون اکسیژن باشد هم فرد را دچار خفگی میکند.
این گاز در حالت مایع توان سردکنندگی بسیار بالایی دارد و آسیبهایی همچون یخزدگی را میتواند به بار آورد؛ دیگر مایعهای بسیار سرد هم میتوانند چنین خطری را داشته باشند. هیدروژن در بسیاری از فلزها حل میشود گاهی این توانایی دلخواه ما نیست مانند امکان نشت به بیرون و پدیدهٔ تردی هیدروژنی که در صورت ادامه باعث ترک خوردگی و یا انفجار میشود. نشت گاز هیدروژن در هوای آزاد باعث شعلهور شدن آن میشود افزون بر این سوختن هیدروژن هنگامی که بسیار داغ باشد، تقریباً پدیدهای ناپیدا (نامرئی) است و میتواند باعث رویدادهای ناگواری شود.
دادههای مربوط به گازهیدروژن از جمله دادههای مربوط به امنیت آن به دستهای از پدیدهها بستگی دارد. بسیاری از ویژگیهای فیزیکی و شیمیایی هیدروژن به نسبت اورتوهیدروژن و پاراهیدروژن گاز وابستهاست که معمولاً روزها و گاهی هفتهها طول میکشد تا در یک دمای مشخص به تعادل برسد و چون دادههای امنیت مربوط به حالت تعادل است کمی کار دشوار میشود همچنین پارامترهای انفجار، مانند فشار و دمای بحرانی به شدت به هندسهٔ ظرف دربردارنده هم بستگی دارد.
هرگز از گاز هيدروژن در نزديكي جوشكاری، شعله هاي باز و يا سطوح داغ استفاده نكنيد. از كشيدن و سر دادن و غلتاندن سيلندرحاوي گازهیدروژن روي زمين خوداري كنيد.
سيلندرهاي حاوي گازهيدروژن را با چرخ دستي يا چيزي شبيه ارابه حمل كنيد. كلاهك سيلندر را هرگز برنداريد. اين سيلندرها را با دستهاي چرب و روغني حمل نكنيد.
هيچگاه بمنظور افزايش سرعت تخليه گاز هیدروژن ، سيلندر را حرارت ندهيد. مراقب باشيد تا صدمات فيزيكي به سيلندرها وارد نشود سيلندرها را بصورت عمودي و كاملاً حفاظت شده در برابر افتادن و ضربه خوردن در محل خشك وخنك انبار شود. محل انبار بايد دور از ترافيك و خروج اضطراري باشد.
-سیلندرهای پر و خالی می بایست بطور جداگانه نگهداری شوند.
-روی کلیه سیلندرها می بایست برچسب (خالی یا پر) نصب شود.
-مخازن و سیلندرهای محتوی گازهای تحت فشار را باید حتی الامکان بطور سربالا در مکان مناسب قرار دهید،
-همچنین بوسیله زنجیر یا کمربندهای فلزی مهار کنید تا از افتادن و آسیب رسیدن به شیر و یا بدنه سیلندر نصب باشد.
-هنگام نگهداری یا زمانی که از سیلندرها استفاده نمی شود، کلاهک سیلندر باید روی شیر سیلندر نصب باشد.
-به دلیل اینکه روغن و گریس به سرعت در مجاورت اکسیژن با فشار بالا آتش گرفته و احتمال انفجار آن افزایش می یابد، می بایست سیلندرها و متعلقات آنها را دور از آنها نگهداری کنید.
-سیلندرها را باید دور از مواد قابل اشتعال مانند مواد نفتی و مواد روغنی و … انبار نمود،
-نباید آنها را در محلی گذاشت که احتمال ریختن مواد نام برده بروی آنها وجود داشته باشد.
-سیلندر گازهای تحت فشار و گازهای مایع شده را نباید تحت هیچ عنوانی در مجاورت کوره ها، بخاری ها و اماکنی که خطر آتشسوزی وجود دارد، انبار کرد.
کاربرد گاز هیدروژن
گاز هیدروژن یا H۲ به فراوانی در صنایع شیمیایی و پتروشیمی کاربرد دارد. بزرگترین کاربرد آن در فراوری سوختهای سنگوارهای و تولید آمونیاک است. مصرفکنندگان کلیدی H۲ در کارخانههای پتروشیمی عبارتند از هیدرودآلکیلاسیون، هیدرودسولفوریزاسیون و کراکینگ. البته هیدروژن چندین کاربرد مهم دیگر هم دارد. هیدروژن در هیدروژنه کردن به ویژه در افزایش سطح اشباع چربیهای غیر اشباع و تولید روغن جامد، دانههای روغنی و تولید متانول کاربرد دارد. کاربرد دیگر آن به عنوان منبع هیدروژن در تولید هیدروکلریک اسید است. همچنین هیدروژن به عنوان عامل کاهنده در احیای سنگ معدنهای فلزی کار میکند.
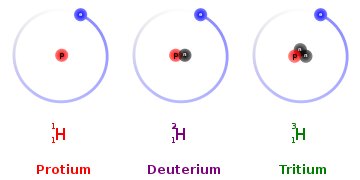
ایزوتوپ های هیدروژن
گاز هیدروژن (H1 بهطور طبیعی دارای ۳ ایزوتوپ است که گاهی به صورت H2,H1, و H3 نشان داده میشوند. دوتای اولی پایدار هستند، درحالی که H3پرتوزا است. همچنین از هیدروژن ایزوتوپهای سنگین تری نیز وجود دارند که همگی مصنوعی (سنتزی) هستند، و در آزمایشگاه تولید می شوند.
هیدروژن مایع
هیدروژن مایع (Liquid hydrogen ) LH2 یک ترکیب شیمیایی با شناسه پابکم ۷۸۳ است. شکل ظاهری این ترکیب، مایع بیرنگ است؛ و خاصیت سرمازایی بالایی دارد.هیدروژن آلایندگی ندارد، در آینده در کنار انرژی الکتریکی به عنوان یک منبع مهم انرژی معرفی خواهد شد.
هیدروژن جامد
هیدروژن جامد، همان حالت جامد عنصر هیدروژن است که با کاهش دمای هیدروژن تا زیر نقطهٔ ذوبش برابر با ۱۴٫۰۱ کلوین یا259- سیلیسوس درجهٔ سانتیگراد بدست آمده است.این ماده سبک ترین جامد شناخته شده است.
قیمت گاز هیدروژن
سپهرگاز کاویان تامین کننده و تولید کننده گازهای خالص در تمام گریدها می باشد.گاز خلوص بالا در واقع گازی است که درصد خلوص آن بیشتر از عدد 99 درصد باشد. بیش تر گاز های مورد استفاده در صنایع درصد خلوص 90 درصد دارند، یعنی 90 درصد از حجم کپسول را گاز مورد نظر و 10 درصد از آن را گاز های دیگر تشکیل می دهند.در بعضی از موارد باید گاز با درصد خلوص بالا باشد تا در دقت اندازه گیری دستگاه ها مشکلی ایجاد نشود.
از گازهای خلوص بالا در صنعت و آزمایشگاه ها استفاده ی گسترده ای می شود. گازهایی نظیر هلیوم، نیتروژن، اکسیژن، آرگون، گاز کربنیک، هیدروژن و. . . مصارف زیادی در این زمینه دارند.سپهرگاز تامین کننده گازهای مصرفی شما در خلوص های پایین و بالا می باشد.
قیمت گاز هیدروژن آزمایشگاهی
گازها به دوصورت آزمایشگاهی و صنعتی در بازار عرضه میگردند.
گاز آزمایشگاهی: گازهای آزمایشگاهی به شکل ﻣﺎﯾﻊ ﯾﺎ ﮔﺎز ﻓﺸﺮده در کپسول ﺑﺎ ﺳﺎﯾﺰﻫﺎی ﻣﺨﺘﻠﻒ با خلوص بالا می باشند که در صنایع گسترده ای کاربرد دارند.کاربردهای گازهای آزمایشگاهی بسیار گسترده است و با توجه به نوع کاربرد گازهای آزمایشگاهی، نوع گاز و میزان خلوص آن مشخص می شود. گاز هیدروژن یکی از این گازها است.از کاربردهای گاز آزمایشگاهی هیدروژن این است که به عنوان گاز حامل دردستگاههای آنالایزر کروماتوگرافی استفاده می شوند . در برخی موارد از گاز هیدروژن جهت گاز خنککننده استفاده میکنندو صنایع غذایی برای ساخت روغن های جامد به کار می رود.
گاز صنعتی: این گازها به صورت انبوه تولید شده و در صنایع مختلف از جمله نفت و گاز، پتروشیمی، نیروگاهها، صنایع شیمیایی و دارویی، صنایع فولاد، صنایع غذایی و صنایع هستهای، کاربرد دارد.
قیمت مخلوط گازی دربالانس هیدروژن
تامین و تولید گاز در بالانس هیدروژن برای ما امکان پذیر می باشد منتظردرخواست شما عزیزان می باشیم. مخلوطهای گازی در بالانس
هیدروژن=آرگون دربالانس هیدروژن
دی اکسید کربن در مونوکسید کربن در بالانس هیدروژن برای پالایشگاه نفت کاربرد دارد.
قیمت خرید گاز کالیبراسیون هیدروژن
یکی از مخلوط های گازی ، گاز کالیبراسیون LEL هیدروژن در Air که بعنوان نشت یاب در واحد های انتقال گاز استفاده می شود از ترکیب 2.5% متان در هوای خشک یا هوای فشرده Z- Air تشکیل شده است.مخلوط گازی 50%LEL هیدروژن در ایر بدلیل استفاده گسترده ای که در سیستم های انتقال گاز دارد معمولا در سیلندرهای یکبارمصرف و قابل حمل توسط اپراتور ها مورد استفاده قرار می گیرد.می توان ازاین نوع گاز کالیبراسیون به عنوان خاص ترین گاز کالیبراسیون نام برد.می توانید با خرید گاز کالیبراسیون هیدروژن به این محصول گازی دست یابید.خرید گاز کالیبراسیون را می توانید از برند سپهرگاز کاویان انجام دهید.
قیمت ترکیبات گازی هیدروژن
معروف ترین ترکیبات گاز هیدروژن هیدروکربن ها می باشد.هیدروکربنها مولکولهایی آلی هستند که تنها از اتم دو عنصر کربن و هیدروژن به وجود آمدهاند. این ترکیبها بهصورت گازی بیرنگ و فاقد بو حضور دارند.هیدروکربنها را با توجه به ساختارشان به دستههای مختلفی تقسیمبندی میکنند.
1_«هیدروکربن آروماتیک» (Aromatic Hydrocarbon): ساختار این نوع هیدروکربنها حاوی حلقه ۶ عضوی به نام «بنزن» (Benzene) است.
2_«هیدروکربن آلیفاتیک» (Aliphatic Hydrocarbon): این نوع از هیدروکربنها دارای ساختاری زنجیرهای هستند.
ترکیب هیدروژن وهلیوک بعنوان گازسوختی کاربرد دارد.ترکیب هیدرژن و نیتروژن در دستگاه آنالیز استفاده میشود.
قیمت رگلاتور
از آنجایی که گاز هیدروژن قابل انفجار است باید از رگلاتوری که دقت بالایی دارد استفاده شود در این صورت، سیلندر حاوی گاز هیدروژن دچار مشکل نخواهد شد.شما برای خرید هر یک از این رگولاتور ها از جمله رگلاتور هیدروژن و رگولاتور آرگون می توانید به سایت سپهر گاز کاویان مراجعه کنید و آن ها را خریداری نمایید.
قیمت میکس گاز هیدروژن
گازهای میکس که مخلوطی از چند گاز مختلف هستند باعث می شوند که بتوان همزمان از مزایای چند گاز بهره برد و به نتایج عالی دست یافت.گاز ترکیبی می تواند با درصد های گوناگون ادغام شود که سپهرگازکاویان قادر به انجام سفارشات میکس گازها در حد ppm و درصد می باشد.
گازهای میکس توسط متخصصان آزمایشگاه سپهرگاز تولید میشوند. بعنوان مثال گازهای میکس هیدروژن درنیتروژن-گازمیکس هیدروژن در دی اکسیدکربن در نیتروژن.
قیمت آنالیز گاز هیدروژن
دستگاه GC یا کروماتوگراف گازی یکی تجهیزات رایج آزمایشگاهی به منظور جداسازی و شناسایی مواد می باشد. این روش اصولا برای آنالیز موادی که در حالت بخار تجزیه نمی شوند مورد استفاده قرار می گیرد. دستگاه GC در مواردی مانند تعیین میزان خلوص یک ماده و جداسازی اجزای مختلف یک ترکیب (با تعیین نسبت اجزا) کاربرد دارد.برای تشخیص خلوص های گازها به آنالیز آن می پردازیم. گازها برای زمان تحویل به مشتری چندین بار آنالیز انجام میگیرد که سپهرگاز کاویان این کار را انجام می دهد.
قیمت گرید5/5
هیدروژن جی سی گرید5/5، گریدها براساس ناخالصی گازها تعیین میشود.
قیمت سیلندر50لیتری
سیلندر 50 لیتری از جنس فولادی بار رنگ های مختلف می باشد. بسته به نوع گاز رنگ سیلندرها متفاوت می باشد. این مخزن همواره از کلاهک برخوردار می باشد.سیلندر50لیتری فشار آن 150بارتا200 بار می باشد. سیلندر 50لیتری با گاز مورد نیاز مشتریان شاژ می کنیم وبه همراه سرتیفیکیت در اختیار شما قرار میدهیم.
قیمت سیلندرکربن استیل گاز هیدروژن
سیلندر از جنس کربن استیل برای گاز هیدروژن مناسب می باشد. سیلندر کربن استیل برای گازهای غیرخورنده کاربرد دارد.
خرید گاز هیدروژن
گاز هیدروژن ( Hydrogen) با نماد شیمیایی H، یک عنصر شیمیایی در جدول تناوبی با عدد اتمی ۱ است. جرم اتمی این عنصر ۱٫۰۰۷۹۴ u است. هیدروژن سبکترین عنصر در جهان بوده و در شرایط استاندارد هیدروژن گازی از مولکولهای دو اتمی با فرمول H2 ساخته میشود.
گازهای خالص و ترکیبی تولیده شده توسط سپهرگاز کاویان دارای بالاتربن کیفیت هستند و شما مشتریان گرامی میتوانید تمامی گازها را با مناسب ترین قیمت خریداری کنید. سپهرگازکاویان تولید کننده وعرضه کننده انواع گازهای خالص و ترکیبی مانند گاز هیدروژن در تمامی شهرها می باشد.
شرکت سپهرگاز کاویان، قادر به تولید گاز هیدروژن در سیلندرهایی با حجم 5 و10و20 و40 و50 لیتر(سیلندرهای کربن استیل) میباشد.گاز هیدروژن با درصد خلوص 99/999 و 99.9992 ، 99.9995 ، 99.9999 قابل ارائه است.
خرید هیدروژن خالص
این عنصر بیرنگ، بیبو، بیمزه، غیر سمی و بسیار قابل احتراق نیز میباشد.هیدروژن فراوانترین ماده شیمیایی در جهان بوده که تقریباً ۷۵٪ از جرم جهان را تشکیل میدهد و بر روی زمین به اشکال مولکولی مانند آب و ترکیبات آلی وجود دارد اما به سختی میتوان تک اتم هیدروژن را بر روی زمین پیدا کرد.گازی است بسیار آتش گیرویک گاز بی رنگ و غیرفلزمی باشد ودرصورت فشاربالا مایع می شود. سبک ترین عنصر هیدروژن می باشد.بااکثر عنصرها ترکیب می شود.
تامین گاز هیدروژن آزمایشگاهی
گاز هیدروژن (با نماد H۲) نخستین بار در سدهٔ ۱۸ میلادی به صورت آزمایشگاهی از واکنش اسیدهای قوی با فلزهایی مانند روی بهدست آمد (۱۷۶۶ تا ۱۷۸۱). هنری کاوندیش نخستین کسی بود که دریافت گاز هیدروژن برای خود، یک مادهٔ جداگانهاست.و از سوختن آن آب پدید میآید. دلیل نامگذاری هیدروژن هم همین ویژگی آن است به معنی آبساز در زبان یونانی. در شرایط استاندارد دما و فشار هیدروژن عنصری است بیرنگ، بیبو، بیمزه، نافلز، غیرسمّی یک ظرفیتی، گازی دو اتمی، بسیار آتشگیر و با فرمول شیمیایی H۲.گازهای آزمایشگاهی گازی حساسی هستند. باگریدها وخلوص های بالا در بازار وجود دارند.
خرید هیدروژن با کیفیت
فراوانترین ترکیباتی که هیدروژن در آنها دخالت دارد، هیدروکربنها هستند که از پیوند بین هیدروژن و کربن در تعداد و شکلهای متفاوت تشکیل میشوند؛ هیدروکربنها ترکیبات اصلی موجود در نفت هستند.این اتم در حالت طبیعی نوترون ندارد. در شرایط عادی (فشار 1 atm و دمای اتاق) گاز هیدروژن از تعداد زیادی جفت اتم (H2) تشکیل شده است که پیوند سستی با یکدیگر دارند.گازها بنابر درخواست شما مصرف کنندگان تولید میگردند.استفاده از گازهای خالص درخلوص بالا برای گازهای کالیبراسیون موجب بالارفتن دقت در کالیبره کردن میشود.
خرید گاز کالیبراسیون هیدروژن
عنصری بی رنگ و بی بو و بی مزه وغیرفلزی و غیرسمی و آتش گیر است.در صنعت برای تولید هیدروژن از گاز طبیعی استفاده می کنند.برای خرید گاز هیدروژن با مشاوران ما تماس بگیرید.
02146837950
02146835980

