- سپهرگاز کاویان تولید کننده و تامین کننده انواع گازهای خالص و ترکیبی
- دارای گواهینامه iso17025
- تهران,کیلومتر 20 جاده قدیم کرج
- 021-46837072
گاز هلیوم
- خانه
- گاز هلیوم
هلیوم یا هلیُم (به انگلیسی: Helium، با نشان شیمیایی He) یک عنصر شیمیایی با عدد اتمی ۲ و وزن اتمی ۴٫۰۰۲۶۰۲ میباشد. این عنصر، بیبو، بیرنگ، بیمزه، غیرسمّی و ازنظر شیمیدانان بیاثر و تک اتمی است که در جدول تناوبی سرگروه گازهای نجیب است. گاز هلیوم در گروه هشتم و ردیف اول جدول تناوبی قرار دارد. هلیوم یک گاز بی اثر است که تمایل به انجام واکنش ندارد چون لایه ظرفیت آن پر شده است. گاز هلیوم در لیزرها و روشنایی استفاده میشود. هلیوم به گاز تشدیدگر در لیزرهای گازی مانند لیزر هلیوم-نئون و لیزر CO۲ و لیزرهای بخار فلز مانند لیزر بخار فلز هلیوم-کادمیوم اعمال میشود. لیزرهای مختلف با هلیوم برای کاربردهای مختلف مانند تحقیقات علمی، تداخلسنجی، هولوگرافی، طیفسنجی، اسکن بارکد، ترازبندی، جراحی لیزر چشم، نمایشهای نوری، برنامههای چاپ و حروفچینی، جوشکاری و برش استفاده میشود. بعلاوه از هلیوم به عنوان گاز فعال در لامپهای تخلیه گاز استفاده میشود. هلیوم رنگهایی طیف سفید تا نارنجی منتشر میکند. لامپهای تخلیه گاز هلیوم توسط هنرمندان برای روشنایی با اهداف خاص استفاده میشود. لیزرهای هلیوم-نئون، لیزرهایی با توان کم و پرتویی قرمز رنگند که کاربردهای عملی متنوعی مانند بارکدخوان و اشارهگر لیزری دارند. البته امروزه این لیزرها، تقریباً در سراسر دنیا با لیزر ارزانتری با نام لیزر دیودی جایگزین شدهاند. گاز هلیوم، پس از نئون، کم واکنشترین گاز نجیب و البته دومین عنصر کم واکنش پذیر در میان همه عنصرهاست. هلیوم کم واکنش در همهٔ شرایط استاندارد به صورت تکاتمی باقی میماند. هلیوم به دلیل داشتن جرم مولی نسبتاً پایین، دارای رسانش گرمایی و ظرفیت گرمایی بالایی است و سرعت صدا هم در آن، در حالت گازی، از هر گاز دیگری به جز هیدروژن، بالاتر است. همچنین به دلیل کوچکی اندازهٔ اتم هلیوم، نرخ واپخش در اجسام جامد، سه برابر بیشتر از نرخ واپخش هوا و برابر با ۶۵٪ نرخ واپخش هیدروژن است.
گاز هلیوم طبیعی در شرایط استاندارد، آسیبرسان نیست. مقادیر بسیار اندکی از این ماده در خون انسان پیدا میشود. تنفس هلیوم بهجای اکسیژن، میتواند منجر به خفگی شود. سرعت صوت در هلیوم نزدیک به سه برابر سرعت آن در هوا است. از طرفی بسامد پایه طبیعی مجرای پر شده با گاز، با سرعت صوت در آن گاز متناسب است؛ بنابراین، هنگامی که فرد گاز هلیوم را تنفس میکند، به علت سرعت بیشتر حرکت صدا در گاز هلیوم در مقایسه با هوای معمولی، بسامد تولیدی توسط مجرای صوتی فرد تشدید میشود که این خود موجب تقویت فرکانس صدای فرد میشود. در صورت استنشاق گازهای سنگینتر از هوا مانند هگزا فلوراید گوگرد یا زنون، عکس حالت فوق رخ میدهد؛ بهطوری که از فرکانس صدای فرد بهخاطر کاهش سرعت صوت در این گازها، کاسته میشود. اگرچه هلیوم از نظر شیمیایی بی اثر است، اما آلودگی هلیوم باعث اختلال در عملکرد سامانه میکرو الکترومکانیکی میشود. برخی از پژوهشگران معتقدند که بهتر است هلیوم بهجای اینکه روی گروه گازهای نجیب قرار داده شود، هلیوم بالای عنصر بریلیوم و گروه فلزات قلیایی خاکی قرار داده شود. آرایش الکترونی، روند پتانسیل یونش و الکترون خواهی، واکنشپذیری، مقایسه ترکیبات شیمیایی و ساختار بلوری آن از دلایلی است که برای این ایده برشمرده میشود. با اینحال، اغلب شیمیدانها، ترجیح میدهند که هلیوم بهخاطر داشتن بیمیلی شیمیایی عجیب و فوقالعاده نزدیکش به گازهای نجیبی مانند نئون و آرگون، بر روی نئون و گروه گازهای نجیب قرار داشته باشد.
گاز هلیوم یک عنصر شیمیایی با عدد اتمی ۲ و وزن اتمی ۴٫۰۰۲۶۰۲ میباشد. این عنصر، بیبو، بیرنگ، بیمزه، غیرسمّی و ازنظر شیمیدانان بیاثر و تک اتمی است که در جدول تناوبی سرگروه گازهای نجیب است دمای ذوب و جوش هلیوم در میان دیگر عنصرها پایینتر میباشد، بههمین دلیل در دمای اتاق و البته در بیشتر موارد حالت گازی شکل دارد مگر اینکه تحت شرایط بسیار ویژهای قراربگیرد. گاز هلیوم، هم از نظر سبکی و هم از نظر فراوانی، دومین عنصر جهان است،ولی با وجود اینکه کاربردهای بسیار مهم و حیاتی دارد، بر روی زمین بسیار کم یافت میشود. نزدیک به ۲۴٪ از جرم زمین، به این عنصر تعلق دارد که این مقدار بیش از ۱۲ برابر ترکیب تمام عنصرهای سنگین میباشد. هلیوم همانطور که در خورشید و مشتری وجود دارد، در جهان نیز یافت میشود و این به دلیل انرژی بستگی (به ازای هر هسته) بسیار بالای هلیوم-۴ نسبت به سه عنصر دیگر بعد از آن، در جدول تناوبی میباشد. بیشتر هلیومی که در کیهان یافت میشود، هلیوم-۴ است و فرض میشود که در جریان مهبانگ بوجود آمده باشد. امروزه با کمک واکنشهای همجوشی هستهای در ستارهها، گونههای جدیدی از هلیوم بوجود آمده است. واژهٔ هلیوم از واژهٔ یونانی هلیوس، به معنای «ایزد خورشید» آمده است. زمانی که هنوز هلیوم ناشناخته بود، ستارهشناس فرانسوی ژول ژانسن در جریان خورشیدگرفتگی سال ۱۸۶۸ برای اولین بار در طیفسنجی نور خورشید، خط زرد طیفی هلیوم را دید؛ برای همین، هنگامی که از نخستین کسانی که گاز هلیوم را کشف کردند یاد میشود، نام ژول ژانسن در کنار نام نورمن لاکیر جای میگیرد. در جریان همان خورشیدگرفتگی، نورمن لاکیر فرض کرد این خط زرد ممکن است به دلیل یک عنصر تازه باشد. دو شیمیدان سوئدی با نامهای پر تئودر کلیو و نیلز آبراهام لانگلت در سال ۱۸۹۵ این عنصر را شناسایی و معرفی کردند. آنها هلیوم را از سنگ کلویت که کانی اورانیوم است، بهدست آوردند. در سال ۱۹۰۳ منابع بزرگ هلیوم در میدانهای گازی ایالات متحده پیدا شد که یکی از بزرگترین منابع این گاز به شمار میاید. گاز هلیوم در سرماشناسی کاربرد مهمی دارد. حدود یک-چهارم هلیوم تولید شده در این زمینه بکار میرود. خنکسازی هلیوم به ویژه در خنک کردن آهنرباهای ابررسانا از ویژگی مهم آن میباشد. این آهنرباها به صورت تجاری در اسکنرهای امآرآی به کاربرد میروند. از دیگر کاربردهای صنعتی هلیوم در تولید فشار است؛ برای مثال،به عنوان گاز تخلیهکننده استفاده میگردد. همچنین به عنوان هوای محافظ در جوشکاری با قوس الکتریکی، در فرایندهایی مانند کشت بلورها در ساخت قرصهای سیلیسیم از این گاز استفاده میشود.حدودا نصف هلیوم تولیدی در این زمینه به کار گرفته میشود. یکی دیگر از کاربردهای معروف هلیوم در ویژگی بالابری در بالونها و کشتیهای هوایی میباشد.استنشاق حجم کمی از گاز هلیوم میتواند برای مدتی در کیفیت و زنگ صدای انسان اثرگذار باشد. این اثرگذاری تنها از آن هلیوم نیست بلکه هر گازی که چگالی متفاوتی با هوا داشته باشد از این ویژگی بهره مند میباشد. درپژوهشهای دانشگاهی، رفتار دو فاز سیال هلیوم-۴ (هلیوم I و هلیوم II) در بحثهای مربوط به مکانیک کوانتوم یا پژوهش دربارهٔ پدیدههایی مثل ابررسانایی که با دماهای نزدیک به صفر مطلق در ماده بوجودمیآید، مهم است. هلیوم در هواکُرهٔ زمین بسیار کم یافت میشود(نزدیک به ۰٫۰۰۰۵۲٪ حجمی). بیشتر هلیومی که در خاک زمین پیدا میشود، در اثر واپاشی هستهای طبیعی درعنصرهای سنگین پرتوزا مثل اورانیوم و توریوم بوجود آمدهاست؛ به این ترتیب که در اثر واپاشی، ذرههای بتا از عنصر تابیده شده و هستهٔ هلیوم-۴ بهدست آمدهاست. هلیومِ تولید شده از واپاشی، به راحتی به صورت فشرده با درصدی نزدیک به ۷٪ حجمی، در دام گاز طبیعی گرفتار میشود. سپس میتوان با روشهای صنعتی و به صورت تجاری با کاهش دمای آمیختهٔ هلیوم و گاز طبیعی، هلیوم را از دیگر گازها جداسازی کرد. به این روش تقطیر جزء به جزء گفته میشود.
واژه هلیوم واژه یونانی هلیوس به معنای «خدای خورشید» آمده است که در خورشید گرفتگی سال 1868 بطور همزمان توسط پیئر جانسن “شیمیدان فرانسوی" و نورمن لوکئیر “شیمیدان انگلیسی" با مشاهده طیف ناشناخته ای با خط زرد در طیف سنجی نور خورشید کشف گردید. امروزه منبع اصلی استخراج و تولید هلیوم، گاز طبیعی یا همان گاز ترش است. ابتدا استخراج هلیوم دمای گاز طبیعی را پایین آورده و مایع هلیوم با خلوص ۸۰ درصد بدست می آید. در این مرحله بسیاری از ناخالصی ها از جمله متان، اتان، پروپان و آرگون و نیتروژن از گاز حذف می گردد. البته امکان استخراج هلیوم از اتمسفر نیز وجود دارد که به دلیل هزینه بالا امکان تولید در حجم زیاد صرفه اقتصادی ندارد. همچنین به خاطر کم بودن هلیوم در جهان، اغلب مصرف کنندگان سیستم هایی را برای بازیابی این گاز دارند.
نخستین نشانهٔ گازهلیوم در ۱۸ اوت سال ۱۸۶۸ به صورت یک میلهٔ زرد رنگ در طول موج ۵۸۷٫۴۹ نانومتر در طیفسنجی فامسپهر خورشید مشاهده شد. این خط زرد رنگ را ستارهشناس فرانسوی ژول ژانسن در هنگام یک خورشیدگرفتگی کامل در گونتور هند شناسایی کرد. در ابتدا فرض میشد که شاید این خط زرد، سدیم است. در ۲۰ اکتبر همان سال، ستارهشناس انگلیسی، نورمن لاکیر یک خط زرد رنگ در طیفسنجی نور خورشید را یافت و چون این خط نزدیک به خطهای شناخته شدهٔ D۱ و D۲ سدیم بود، آن را D۳ خطهای فرانهوفر نامید. او حدس زد که این خط باید توسط یک عنصر درون خورشید که در زمین شناخته نشده، پدید آمده باشد. لاکیر و شیمیدان انگلیسی ادوارد فرانکلند واژهٔ یونانی ایلیوس (یا هلیوس) به معنی «خورشید» را برای هلیوم انتخاب کردند. در ۱۸۸۱، فیزیکدان ایتالیایی، لوئیجی پالمیری، هنگامی که خطهای طیفی D۳ گدازههای آتشفشان وزوو رابررسی میکرد موفق شد برای اولین بار هلیوم را در زمین شناسایی کند. در ۲۶ مارس ۱۸۹۵ شیمیدان اسکاتلندی ویلیام رمزی توانست، هلیوم کانی کلویت را با استفاده از اسیدهای معدنی به دام اندازد. کلویت، آمیختهای از اورانینیت و دست کم ۱۰٪ عنصرهای خاکی کمیاب است. رمزی در جستجوی آرگون بود، اما پس از جداسازی نیتروژن و اکسیژن از گاز آزاد شده با کمک اسید سولفوریک، در طیفسنجی خود به یک خط زرد روشن رسید که با خط D۳ مشاهده شده در طیفسنجی خورشید هماهنگ بود. این نمونهها از سوی لاکیر و فیزیکدان بریتانیایی، ویلیام کروکز به عنوان هلیوم شناسایی شد. در همان سال به صورت جداگانه، دو شیمیدان با نامهای پر تئودر کلیو و نیلز آبراهام لانگلت، در اوپسالای سوئد موفق شدند هلیوم کلویت را به دام اندازند. مقدار گازی که آنها جمعآوری کردند، برای اندازهگیری دقیق وزن اتمی آن کافی بود. دانشمند آمریکایی زمینشیمی، ویلیام فرانسیس هیلهبراند پیش از دستآورد رمزی، هنگام طیفسنجی نمونه کانیهای اورانینیت فهمیده بود که خطهای طیفی غیرمعمولی در نتیجههایش یافت میشود. اما هیلبرند فرض کرد که این خطهای طیفی مربوط به نیتروژن است. نامهٔ تبریک او به رمزی چیزی نزدیک به یک کشف علمی در نظر گرفته میشود. در سال ۱۹۰۷ ارنست رادرفورد و توماس رویدز ثابت کردند که ذرههای آلفا همان هستهٔ گاز هلیوم میباشد. آنها برای این کار، اجازه دادند تا ذرهها در دیوار شیشهای نازک یک لولهٔ تهی نفوذ کند. سپس لوله را تخلیه کردند تا گاز تازهٔ جمع شده در آن را طیفسنجی کنند. در سال ۱۹۰۸ یک فیزیکدان هلندی به نام هایک کامرلینگ اونس موفق شد دمای هلیوم را به زیر یک کلوین برساند و آن را تبدیل به مایع کند. همچنین او تصمیم داشت گاز هلیم را سرد کند و هلیم جامد را بدست آورد دلیل عدم موفقیت او این بود که هلیوم دارای نقاط سهگانه نمیباشد؛ یعنی دارای دمایی نمیباشد که در آن حالتهای جامد، مایع و گازی در تعادل با یکدیگر باشند. پس از چند سال، در ۱۹۲۶ ویلم هندریک کیزوم که دانشجوی اونس بود موفق شد 1 cm۳ هلیوم را با افزودن فشار، تبدیل به جامد کند.در ۱۹۳۸، فیزیکدان روس، پیوتر کاپیتسا متوجه شد که در دمای نزدیک به صفر مطلق، گاز هلیوم-۴ تقریباً هیچ گرانروی ندارد که امروزه به این پدیده ابرشارگی میگویند. این پدیده با چگالش بوز-اینشتین در ارتباط است. در سال ۱۹۷۲ همین پدیده در هلیوم-۳ اما این بار در دمایی بسیار نزدیک تر به صفر مطلق، مشاهده شد. دانشمندان آمریکایی داگلاس اوشروف، دیوید موریس لی و رابرت کلمن ریچاردسون کسانی بودند که به ابرروانروی در هلیوم-۳ پی بردند. با در نظر گرفتن جفتهای کوپر الکترونها که پدیدآورندهٔ ابررسانایی میباشند، فرض میشود که ابرگرانروی دیده شده در هلیوم-۳ نیز بهصورت قابل مقایسهای به جفتشدن فرمیونهای گازهلیوم-۳ در جهت تولید بوزونها ربط دارد. هلیوم در بسیاری از صنایع در سطح جهانی استفاده میشود و استفاده از آن در همه زمینههای تحقیقات علمی و محیطهای تجاری، از جمله داروسازی، پزشکی، جوشکاری، علوم رایانه، اکتشافات فضایی وجود دارد. در سال ۲۰۱۴، تولید جهانی هلیوم حدود ۳۲ میلیون کیلوگرم (۱۸۰ میلیون متر مکعب استاندارد) بود. بیشترین میزان مصرف در این سال، مربوط به کاربردهای کرایوژنیک بود که حدوداً ۳۲٪ از کل مصرف گاز هلیوم را شامل میشد. کاربردهای کرایوژنیک شامل خنک کردن آهنرباهای ابررسانا در اسکنرهای امآرآی پزشکی و طیفسنجهای انامآر است. رتبههای بعدی مصرف هلیوم در سال ۲۰۱۴، سیستمهای فشار و پاکسازی، نگهداری اتمسفرهای کنترلشده و تشخیص نشت بود. سایر حوزههای مصرف هلیوم، درصدهای کم و نسبتاً جزئی داشتند. از دیگر کاربردهای مهم گاز هلیوم، ایجاد فشار، هوای پیرامونی کنترل شده و جوشکاری است که ۷۸ درصد از کل مصرف هلیوم در سال ۱۹۹۶ را تشکیل دادهاست. از گاز هلیوم در فضاپیماها، تلسکوپها و دستگاه نظارت بر پرتونگاری هستهای استفاده میشود
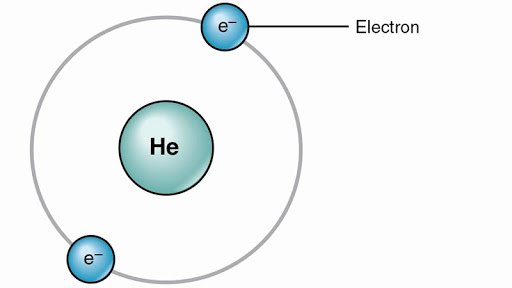
هلیوم کوچکترین عضو خانواده گازهای نجیب ( بی اثر) در جدول تناوبی میباشد که با فرمول شیمیایی He و عدد اتمی ۲ نشان داده میشود.
1.نقطه جوش پایین 2.چگالی کم 3.حلالیت کم 4.هدایت حرارتی بالا 5.عدم نفوذ
اکثر ترکیبات جامد هلیوم با دیگر مواد نیاز به فشار زیاد دارند. گاز هلیوم با دیگر اتمها پیوند ندارد، اما این مواد میتوانند ساختار بلوری منحصر به فردی داشته باشند. دیاکسید سدیم سیلیکات ها ترکیب هلیوم آرسنولیت پروسکایتها فولرایتها اندوهدرال
کاربرهای تجاری و تفریحی هلیوم
بهعنوان یک گاز تنفسی، گاز هلیوم دارای اثرات خواب آلودگی نیست. بنابراین مخلوط گازهای حاوی هلیوم مانند تریمیکس، هلیوکس و هلیایر، برای غواصی در آبهای عمیق به کارگرفته میشوند و باعث میشود خواب آلوده شدن غواص در اعماق بیشترِ آب، کنترل شود.هرچه با افزایش عمق، فشار آب افزایش مییابد، چگالی گاز تنفسی نیزبیشتر میشود. برای حل این مشکل و تنفس آسانترِ مخلوطِ گاز تنفسی، حضور هلیوم با جرم مولکولی کم، بهطور قابل ملاحظهای تاثیرگذار است. اضافه شدن هلیوم به مخلوط گاز تنفسی، موجب کاهش عدد رینولدز میشود که در نتیجه جریان آشفتگی کاهش و جریان آرام بیشتذر میشود و تنفس راحتتر انجام میپذیرد. غواصانی که درعمقهای بیشتر از ۱۵۰ متر (۴۹۰ فوت) از سطح دریا، مخلوطی از هلیوم-اکسیژن را تنفس میکنند، دچار لرزش و کاهش عملکرد حرکتی میشوند که از نشانههای سندرم عصبی فشار بالااست. این اثر امکان دارد تا حدی با استفاده از افزودن مقداری از گازهای خوابآور مانند هیدروژن یا نیتروژن به مخلوط هلیوم-اکسیژن، کمتر شود. لیزرهای گاز هلیوم-نئون، لیزرهایی با توان کم و پرتویی قرمز رنگ هستند که کاربردهای عملی گوناگونی مانند بارکدخوان و اشارهگر لیزری دارند. البته امروزه این لیزرها، تقریباً در سراسر دنیا با لیزر ارزانتری با نام لیزر دیودی جایگزین میشوند. هلیوم بهعلت واکنشپذیر نبودن و هدایت گرمایی زیاد، شفافیت نوترونی و همچنین بهاین دلیل که در رآکتورها باعث تشکیل ایزوتوپهای پرتوزا نمیشود، بهعنوان یک محیط انتقال حرارت در برخی از رآکتورهای هستهای سرد شده با گاز مورد استفاده قرار میگیرد. مخلوط هلیوم با گازهای سنگینتر مثل زنون، نسبت ظرفیت حرارتی بالا و عدد پرنتل پایینی دارد و برای سردسازی ترموآکوستیک کاربرد دارد. استفاده هلیوم در سیستمهای سردسازی، نسبت به روشهای قدیمی، دارای فواید زیستمحیطی است؛ چون هلیوم تمایلی به انجام واکنش شیمیایی ندارد به همین دلیل اثرات سوئی مانند تخریب لایه ازون و گرمایش جهانی بر جای نمیگذارد. هلیوم درساخت برخی از هارد دیسکها کاربرد دارد.
برای پر کردن بالون هواشناسی، علاوه بر هیدروژن از گاز هلیوم نیز استفاده میگردد. منظور از گاز کالیبراسیون چیست هلیوم یک گاز حامل رایج برای کروماتوگرافی گازی میباشد. سن سنگها و مواد معدنی حاوی اورانیوم و توریم را میتوان با اندازهگیری میزان هلیوم با فرایندی موسوم به تاریخگذاری هلیوم تخمین زد. گاز هلیوم در دماهای پایین در بیماریهای کرایوژنیک و در برخی از کاربردهای خاص بیماری کرایوژنیک استفاده میگردد. به عنوان نمونه کاربردی، هلیوم مایع برای خنک کردن فلزات خاص به دمای بسیار کم مورد نیاز برای ابررسانایی، از جمله در آهنرباهای ابررسانا برای تصویرسازی تشدید مغناطیسی استفاده میشود. برخورددهنده هادرونی بزرگ در سرن از ۹۶ تن هلیوم مایع برای حفظ دما در ۱٫۹ کلوین استفاده میکند.
گاز هلیوم در آوریل ۲۰۲۰ برای استفادههای پزشکی در ایالات متحده برای انسان و حیوانات تایید شد. تنفس گاز هلیوکس (ترکیبی از گازهای اکسیژن و هلیوم) موجب کاهش مقاومت در مقابل عبور جریان هوا در زمان تنفس میگردد. اثرات مفید این موضوع در بیماران مبتلا به آسم، مشکلات حاد تنفسی و برونشیت مشاهده شدهاست. گاز هلیم اکثرا بعنوان گازی بالابرنده در بالونها استفاده میگردد که از آنها بهترتیب برای تبلیغات ، تحقیقات جوی ، شناساییهای نظامی و بعنوان یک چیز بدیع استفاده میگردد. علاوه بر این هلیم دارای قدرت بالابرندگی 92,64% هیدروژن است، اما برعکس آن قابل اشتعال نبوده ، بنابراین ایمنتر ازهیدروژن بهحساب میآید. دارای کمترین نقطه ذوب و جوش در میان عناصر است که این ویژگی، مایع هلیم را به خنک کننـده ای ایدهآل برای اهدافی که دمای بسیار پایین نیاز دارند، تبدیل میکند، از جمله آهنرباهای ابررسانا و تحقیقات سرما شناسی که در آنها دمای نزدیک به صفر مطلق نیاز است. گاز هلیوم بعنوان یک خنثی و حامل بعنوان مثال در گاز رنگکاری کاربرد دارد. همجوشی هیدروژن به هلیم انرژی لازم برای بمبهای اتمی را تامین میکند. زمان با پیشرفت تکنولوژی MRI) magnetic resonance imaging) در مصارف پزشکی ، استفاده از هلیم مایع در MRI رو به افزایش میباشد.
در جوشکاری ها از گاز هلیوم به عنوان یک محافظ در فضا استفاده میگردد. وجود یک گاز بی اثر در فضا به هنگام جوشکاری می تواند از فلزهای داغ در برابر اکسیداسیون و دیگر عکس العمل هایی که احتمال به وجود آمدن آن در دمای بالا وجود دارد محافظت میکند. این قابلیت حفاظتی هلیوم توانسته این عنصر را در جوشکاری مورد توجه قرار دهد.
و اما باید کاربرد سیلندر گاز هلیوم در غواصی را بدانیم. هلیوم می تواند جایگزینی برای گازهای ترکیبی مورد استفاده غواصان نیز باشد. استفاده از هلیوم در این گازهای ترکیبی به غواصان اجازه می دهد تا به که به عمق بیشتری از دریاها و اقیانوس ها برسند بدون اینکه تاثیری منفی در سیستم عصبی مرکزی آنها به وجود بیاید. اگراز هلیوم درگازهای ترکیبی مرتبط با غواصان استفاده نشود، فشار های زیادی بر غواصان در عمق های زیاد وارد می شود که این موقعیت را “the bends ” نامگذاری میکنند. منظور از گاز ترکیبی چیست
گاز هلیوم ها نقش بزرگ و اساسی در ایمنی وسایل نقلیه دارند. گازهلیوم برای پر کردن ایربگ های ایمنی موجود در وسایل نقلیه کاربرد دارد. این کاربرد هلیوم توانسته اهمیت این گاز را بیشتر کند.گاز هلیوم ها نقش بزرگ و اساسی در ایمنی وسایل نقلیه دارند. گازهلیوم برای پر کردن ایربگ های ایمنی موجود در وسایل نقلیه کاربرد دارد. این کاربرد هلیوم توانسته اهمیت این گاز را بیشتر کند.
هلیوم طبیعی در شرایط استاندارد، آسیبرسان نمیباشد. مقادیر بسیار کم از این ماده در خون انسان یافت میشود. استنشاق هلیوم بهجای اکسیژن، میتواند منجر به خفگی شود. هلیوم مایع دارای دمای بسیار پایینی است و تماس با آن میتواند باعث سوختگی در اثر سرما گردد. از اینرو، نکات ایمنی گفته شده دربارهٔ هلیوم مایع و کار با آن همانند موارد گفته شده برای نیتروژن مایع میباشد. سرعت صدا در هلیوم نزدیک به سه برابر سرعت آن در هوا میباشد. از طرفی بسامد پایه طبیعی مجرای پر شده با گاز، با سرعت صوت در آن گاز متناسب است؛ به همین دلیل، هنگامی که فرد گاز هلیوم را استنشاق میکند، به علت سرعت بیشتر حرکت صدا در گاز هلیوم در مقایسه با هوای معمولی، بسامد تولیدی توسط مجرای صوتی فرد تشدید میگردد که این خود موجب تقویت فرکانس صدای فرد میشود در صورت تنفس گازهای سنگینتر از هوا مانند هگزا فلوراید گوگرد یا زنون، عکس حالت بالا ایجاد میشود؛ بهطوری که از فرکانس صدای فرد بهخاطر کاهش سرعت صوت در این گازها، کم میشود. اگرچه این عنصر از نظر شیمیایی بی اثر میباشد، اما آلودگی هلیوم باعث اختلال درکارکرد سامانه میکرو الکترومکانیکی میشود. تنفس بیش از حد گاز هلیوم خطرناک است؛ زیرا گاز هلیوم یک آسفیکسی ساده است و اکسیژن مورد نیاز برای تنفس طبیعی را جابجا میکند. دراثر غیرعادی شدن تنفس، رسیدن اکسیژن به بدن به سختی انجام میگیرد. گزارشهایی از مرگ میر بر اثر تنفس گاز هلیوم وجود دارد برای مثال درسال ۲۰۰۳ در ونکوور یک جوان و در سال ۲۰۰۶ در فلوریدای جنوبی دو بزرگسال به همین دلیل جان خود را از دست دادند. درسال ۱۹۹۸ در ویکتوریا، استرالیا دختری به دلیل تنفس کل محتوای یک بادکنک مهمانی حاوی هلیوم بیهوش شد و بهطور موقت دچار کبودی شد. تنفس هلیوم بهطور مستقیم از سیلندرهای تحت فشار یا حتی شیرهای پر کننده بادکنک بسیارعمل خطرناک میباشد، زیرا سرعت و فشار زیاد جریان باعث به باروتروما و پارگی کشنده بافت ریه شود. مرگ ناشی ازگازهلیوم کم پیش میآید. اولین پرونده ثبت شده در رسانهها مربوط به یک دختر ۱۵ ساله و اهل تگزاس بود که در سال ۱۹۹۸ در اثر تنفس هلیوم در مهمانی یکی از دوستانش جان خود را از دست داد. نوع دقیق مرگ گازهلیوم مشخص نیست. درایالات متحده بین سالهای ۲۰۰۰ تا ۲۰۰۴ مرگ دو نفر گزارش شد، از جمله مردی که در سال ۲۰۰۲ در کارولینای شمالی در اثر باروتروما درگذشت. در سال ۲۰۰۳ در ونکوور، جوانی دچار آسپیراسیون ریوی شد و یک مرد ۲۷ ساله نیز در استرالیا بعد از تنفس از یک کپسول گاز هلیوم در سال ۲۰۰۰ دچار آمبولی شد.سال ۲۰۱۳ در میشیگان نیز دختری بر اثر هیپوکسی مرد. در ۲۸ ژانویه، یکی از اعضای یک گروه موزیک ژاپنی، هنگام ضبط برنامه تلویزیونی پس از تنفس گازهلیوم در حین ضبط دچار آمبولی ریه شد و به کما رفت. این حادثه تا یک هفته بعد؛ یعنی ۴ فوریه ۲۰۱۵ آشکار نشد.
موارد ایمنی گاز هلیوم کرایوژنیک مشابه موارد با نیتروژن مایع است. دمای بسیار پایین آن میتواند منجر به سوختگی سرما شود و در صورت عدم نصب وسایل فشارسنج، نسبت انبساط مایع به گاز میتواند باعث انفجار میگردد. ظروف گاز هلیوم در دمای ۵ تا ۱۰ کلوین به دلیل انبساط حرارتی سریع و قابل توجه که هنگام گرم شدن گاز هلیوم در کمتر از ۱۰ کلوین به دمای اتاق میرسد باید به گونهای مورد استفاده قرار میگیرد که گویی حاوی هلیوم مایع هستند.اوت ۲۰۲۰ یک مخزن هلیوم که درون کیسه زباله خانگی گذاشته شده بود حین ورود به دستگاه جمعکننده زباله در اثر برخورد منفجر و بقایای مخزن تا ۱۰۰ فوت دورتر از کمپکتور پراکنده شده بود. باتوجه به این نکات افراد سودجویی هستند که برای منافع خود از ترکیب گاز متان با هلیوم استفاده میکنند. در این صورت با کوچکترین جرقه فشفشه و یا فندک در نزیک بادکنک میترکد و همچنین سبب آتش گرفتن و سوختن موهای افراد نزدیک بادکنک نیز میشود.
در حالت مایع آیا گاز هلیوم خطرناک است؟ هلیوم مایع دمای بسیار کمی دارد و اگر به صورت مایع با بافت بدن به ویژه پوست تماس پیدا کند، منجر به سوختگی شدید و آسیب های دیگر پوستی میگردد. به همین دلیل باید از تماس با هلیوم مایع خودداری کرد. اما گاز هلیوم در صورت تماس با پوست خطری در پی ندارد.
خطر آمبولی و پاره شدن ریه: گاهی افراد برای تفریح و تغییر صدا کار خطرناکیانجام میدهند. این کار بسیار خطرناک تنفس گاز هلیوم به صورت مستقیم ازسیلندر است. گاز فشرده درون کپسول با فشار وارد ریه ها شده و منجر به آمبولی می گردد. آمبولی نوع انسداد در رگ هاست که منجر به سکته، تشنج و حتی مرگ شود. تنفس گاز دارای فشار زیاد می تواند آسیبی جدی به بافت ریه ها بزند. در صورت پارگی ریه ها فرد دچار مرگ میشود.
گاز هلیوم با آزاد شدن در هوا به سرعت به سمت جو حرکت می کند. هر چند بی رنگ بودن این گاز باعث میشود شما این حرکت را نبینید. اما اگر بادکنک هلیومی را در هوا رها کنید می توانید ارتفاع گرفتن آن را با چشم ببینید. بادکنک تا ارتفاع مشخصی بالا رفته و سپس می ترکد. البته توصیه نمی کنیم که هرگز بادکنک هلیومی را در فضا رها کنید زیرا این بادکنک ها آلودگی محیط زیست به وجود میاورد. بادکنک هلیومی و آتش: گاز هلیوم ابداً آتش گیر نیست. اما گاز هیدروژن نیز که مانند هلیوم گاز سبکی است و بعضاً از آن برای پر کردن بادکنک استفاده می کنند، بسیار آتشگیر است. استفاده از گاز هیدروژن به جای گاز هلیوم معمولاً به خاطر قیمت ارزان تر و دسترسی راحت تر به آن است. اما باید این احتمال را در نظر گرفت که بادکنک در مجاورت شمع کیک تولد فاجعه به بار بیاورد. دانستن اثرات گاز هلویم بر بدن و نیز بر محیط زیست و غیره بر نحوه درست استفاده از آن موثراست.
گاز هلیوم به خودی خود یک گاز نجیب و بی خطر است، همچنین به دلیل عدم ترکیب شدن با اکسیژن قابل اشتعال نیست. اما با این وجود آیا گاز هلیوم خطرناک است؟ یا اینکه به طور کلی می توان آن را بی خطر در نظر گرفت؟ نکته ای که در این جا وجود دارد ناخالصی های همراه با این گاز است،که اگر شما در خرید خود نهایت دقت را نداشته باشید و از مکان مناسب و مطمئن خرید نکنید، این موضوع به نسبت کوچک میتواند خطرات جبران ناپذیری را به بار آورد. در حالی که با خرید از مکان مناسب و قابل اطمینان ناخالصی های گاز هلیوم نهایت 1درصد است. با این حال اگر از مکان نامطمئن خرید کنید این ناخالصی ها میتواند خیلی خطرناک باشد و سبب انفجار و یا آتش سوزی نیز بشوند. بیشتر بخوانید| گاز کالیبراسیون متان چیست باتوجه به این نکات هستند افراد سودجویی که برای منافع خود از ترکیب گاز متان با هلیوم استفاده میکنند. در این صورت با کوچکترین جرقه فشفشه و یا فندک در نزیک بادکنک باعث انفجار آن شده و همچنین سبب آتش گرفتن و سوختن موهای افراد نزدیک بادکنک نیز میشود.
در انبار كردن سيلندر گاز در نظر داشتن اين نكات ضروري مي باشد: اطلاع در مورد ماهيت گازها مهم است و افراد بايد در مورد مشخصات گازها و خطرات حمل و نقل و انبار كردن سيلندرها اطلاعات داشته باشند. نکته: -از دسترسي به محل انبار و محوطه انبار از طريق سطوح صاف و خشك با آبراه هاي مناسب اطمينان حاصل نماييد. -سيلندرها بايد در حالت عمودي بر سطح صاف و خشك با آبراه هاي مناسب محكم بسته شوند. -سيلندرها را در مکانی مشخص دور از احتمال آتش سوزي ، گرما و منبع احتراق ، در فضاي باز نگهداري كنيد. -از وجود تابلوهاي خطر به ميزان كافي در محل انبار اطمينان داشته باشید. -هيچ گاه در نزديكي انبار از سيلندرها استفاده نگردد.
برای ثبت درخواست خود میتوانید با شماره های زیر با کارشناسان ما در ارتباط باشید. 021-46837072 021-46835980 021-46837950 021-46825845 021-46825765
شرکت سپهرگازکاویان تولید کننده و تامین کننده گازهای آزمایشگاهی مانند گاز هلیوم و مخلوط گازی ( تولید گازهای کالیبراسیون با تکیه بر اخذ گواهینامه Iso17025 همراه با سرتیفیکیت) با کیفیت و خلوص بالا و همچنین کالیبره کردن تمامی تجهیزات وابسته به صنایع مختلف فعال می باشد. شما میتوانید برای استعلام قیمت گاز هلیوم و دریافت اطلاعات با بخش فروش تماس گرفته تا کارشناسان ما شما را راهنمایی کنند. 02146837950 گاز هلیوم وارداتی در سیلندر های 50لیتری با فشار 200 بار و رنگ سیلندر قهوه ای به فروش میرسد. گاز هلیم وارداتی خنثی میباشد. از گاز هلیم برای مشخص کردن نشتی در مخزن ها استفاده میشود هلیم وارداتی تامین شده توسط سپهرگازکاویان با کیفیت بالا و سرتیفیکیت معتبر به مشتریان عرضه میگردد. سپهرگازکاویان آزمایشگاه مرجع می باشد و تمامی گازهای خالص و گاز هلیوم تامین شده دارای بالاترین کیفیت را در اختیار مشتریان قرار میدهد. قیمت گاز هلیوم در حجم 5،10،20و 50لیتری با خلوص 5/2(99/9992)،5/5(99/9995)و 6(99/9999) با بالاترین کیفیت و مناسب ترین قیمت توسط سپهرگازکاویان ارائه میگردد. کپسول گاز هلیوم آزمایشگاهی در حجم 50لیتری با فشار 200 بار به فروش میرسد.کپسول هلیم تامین شده توسط سپهرگازکاویان مورد آزمون قرار گرفته شده و با بالاترین کیفیت ارائه میگردد. برای خرید کپسول گاز هلیوم می توانید درخواست خود را برای همکاران ما از طریق واتساپ وایمیل ارسال نمایید. واتساپ: 09128699025 ایمیل: sale@kavianmixgas.com سپهرگازکاویان تامین کننده گاز هلیوم وارداتی با خلوص 5/2و 5/5 و6 می باشد.قیمت گاز هلیوم در تمامی ابعاد با بالاترین کیفیت و مناسب ترین قیمت توسط سپهرگازکاویان آزمایشگاه مرجع اداره استاندارد ارائه میشود برای کسب اطلاعات بیشتر تماس حاصل فرمایید. 02146837950 گاز هلیوم آزمایشگاهی خلوص بالا به عنوان گاز حامل و پاکسازی استفاده برای طیف وسیعی از ابزار تحلیلی از جمله: آشکارساز یونیزاسیون شعله، آشکارساز هدایت حرارتی، ماشین آلات ضبط سنج، شعله فوتومتریک سنج، تبدیل فوریه مادون قرمز طیف سنجی استفاده میشود.گاز هلیوم خالص آزمایشگاهی جزء پرکاربرد ترین گازها در صنعت است. گازهلیوم خالص در ابعاد 5لیتری،10لیتری،20لیتری و 50 لیتری شارژ میگردد از خلوص بالا هلیم به عنوان گرید تحقیقاتی نیز یاد میشود. تمامی گازهای خالص و گازهلیوم و گازهای ترکیبی تولید شده توسط سپهرگاز کاویان دارای بالاترین کیفیت می باشند. تمامی گازهای ارائه شده توسط شرکت سپهرگازکاویان چند دوره با آنالایزر های با دقت بالا آنالیز میشوند و با سرتیفیکیت معتبر و قابل پیگیری به مشتریان تحویل داده میشود. شارژ گاز هلیوم وارداتی از جمله فعالیت های صنعتی سپهرگازکاویان می باشد. شارژ گاز هلیوم در ابعاد 5 لیتری ،10لیتری، 20لیتری و 50 لیتری در سیلندر(کپسول)کربن استیل یا در صورت نیاز مشتری در کپسول آلومینیومی انجام میشود که دارای سرتیفیکیت معتبر و قابل پیگیری هستند. رگولاتور بر روی شیر گاز هلیوم وصل میشود و با بازکردن شیر، گازهلیوم وارد رگولاتور میشود. شیر سیلندر گاز هلیوم جهت تنظیم یا کنترل جریان گاز مورد استفاده قرار میگیرد که با توجه به اینکه هلیوم گازی غیرخورنده است شیر سیلندر هلیم را از جنس برنج می سازند. گازهای میکس که مخلوطی از چند گاز مختلف هستند باعث می شوند که بتوان همزمان از مزایای چند گاز بهره برد و به نتایج عالی دست یافت. هر یک از گازها دارای خواص ویژه ای هستند که در صورت مخلوط شدن، گازی به وجود می آید که همه ویژگی های مثبت آنها را در قالب یک محصول ارائه می دهد.سپهرگازکاویان تولیدکننده انواع گازهای ترکیبی و گاز میکس هلیوم بابالاترین کیفیت می باشد. انواع گاز میکس هلیوم از 2 جزئی تا20جزئی مطابق استاندارد توسط آزمایشگاه سپهرگازکاویان مطابق با درخواشت شما قابل تولید می باشد. دتکتور گازی (Gas Detector) یکی از انواع دتکتور های موجود در بازار است که جزء یکی از تجهیزات اعلام حریق نیز می باشد و وسیله ای است جهت تشخیص گاز موجود در محیط که پیش از وقوع حادثه این دتکتور قادر به آشکار سازی و اعلام وجود گازهای سمی و خطرناک است.دتکتور گاز یا سنسور گاز تجهیزاتی برای شناسایی و مانیتورینگ گازهای سمی ،آتش زا و اکسید کننده استفاده میشود. از دتکتور ها برای گازهای خطرناک در مراکز حساس استفاده میشود برای اطلاع از قیمت دتکتورگاز هلیوم با دفتر سپهرگاز کاویان تماس حاصل فرمایید. گاز هلیوم در گروه گازهای غیرخورنده قرار میگیرد. سیلندر فولادی گاز هلیوم در حجم های مختلف 5 لیتری 10لیتری،20 لیتری و 50لیتری قابل شارژ می باشد و ازین رو که گاز هلیوم باعث خورندگی سیلندر یا کپسول نمی شود میتوان از سیلندر فولادی استفاده نمود.
هلیوم به همان صورت که در خورشید و مشتری یافت میشود، در جهان پیدا میشود و این به دلیل انرژی بستگی (به ازای هر هسته) بسیار بالای هلیوم-۴ نسبت به سه عنصر دیگر پس از آن، در جدول تناوبی است. بیشتر هلیوم موجود در کیهان، هلیوم-۴ است و گمان میرود که در جریان مهبانگ پدید آمده باشد. امروزه با کمک واکنشهای همجوشی هستهای در ستارهها، گونههای تازهای از هلیوم ساخته شدهاست. بیشتر بخوانید | خرید گاز سولفید هیدروژن گازهای خالص و ترکیبی تولیده شده توسط سپهرگاز کاویان دارای بالاتربن کیفیت هستند و شما مشتریان گرامی میتوانید تمامی گازها را با مناسب ترین قیمت خریداری کنید. سپهرگازکاویان تولید کننده وعرضه کننده انواع گازهای خالص و ترکیبی مانند گاز هلیوم(گاز هلیم) در تمامی شهرها می باشد. هلیوم، پس از نئون، کم واکنشترین گاز نجیب و البته دومین عنصر کم واکنش پذیر در میان همه عنصرهاست. این گاز کم واکنش در همهٔ شرایط استاندارد به صورت تکاتمی باقی میماند. هلیوم به دلیل داشتن جرم مولی نسبتاً پایین، دارای رسانش گرمایی و ظرفیت گرمایی بالایی است و سرعت صدا هم در آن، در حالت گازی، از هر گاز دیگری به جز هیدروژن، بالاتر است. همچنین به دلیل کوچکی اندازهٔ اتم هلیوم، نرخ واپخش در اجسام جامد، سه برابر بیشتر از نرخ واپخش هوا و برابر با ۶۵٪ نرخ واپخش هیدروژن است. هلیوم در گریدهای 99/9992،99/9995،99/9999 قابل ارائه میباشد.هلیوم در سیلندر 50 لیتری کربن استیل موجود میباشد. هلیوم دومین عنصر فراوان بعد از هیدروژن در کیهان و در منظومه شمسی است و حدود ۱۱٫۳ درصد از کل اتمهای جهان را تشکیل میدهد. حدود ۸۸٫۶ درصد از کل اتمهای جهان هیدروژن هستند؛ بنابراین، حداقل ۹۹٫۹ درصد از کل اتمها شامل اتمهای هیدروژن یا هلیوم هستند. در مقابل، هلیوم در زمین بسیار نایاب است. این گاز پس از نیتروژن، اکسیژن، آرگون، دیاکسید کربن و نئون ششمین گاز فراوان در جو است که تقریباً ۰٫۰۰۰۵۲۴ درصد هوا را تشکیل میدهد. تخمین میزان هلیوم در پوسته زمین غیرممکن است. گاز هلیم وارداتی خنثی میباشد. از گاز هلیم برای مشخص کردن نشتی در مخزن ها استفاده میشود هلیم وارداتی تامین شده توسط سپهرگازکاویان با کیفیت بالا و سرتیفیکیت معتبر به مشتریان عرضه میگردد. هلیوم در بسیاری از صنایع در سطح جهانی استفاده میشود و استفاده از آن در همه زمینههای تحقیقات علمی و محیطهای تجاری، از جمله داروسازی، پزشکی، جوشکاری، علوم رایانه، اکتشافات فضایی وجود دارد. در سال ۲۰۱۴، تولید جهانی هلیوم حدود ۳۲ میلیون کیلوگرم (۱۸۰ میلیون متر مکعب استاندارد) بود. بیشترین میزان مصرف در این سال، مربوط به کاربردهای کرایوژنیک بود که حدوداً ۳۲٪ از کل مصرف هلیوم را شامل میشد. کاربردهای کرایوژنیک شامل خنک کردن آهنرباهای ابررسانا در اسکنرهای امآرآی پزشکی و طیفسنجهای انامآر است. رتبههای بعدی مصرف هلیوم در سال ۲۰۱۴، سیستمهای فشار و پاکسازی، نگهداری اتمسفرهای کنترلشده و تشخیص نشت بود. سایر حوزههای مصرف هلیوم، درصدهای کم و نسبتاً جزئی داشتند. از دیگر کاربردهای مهم، ایجاد فشار، هوای پیرامونی کنترل شده و جوشکاری است که ۷۸ درصد از کل مصرف هلیوم در سال ۱۹۹۶ را تشکیل دادهاست. از گاز هلیوم در فضاپیماها، تلسکوپها و دستگاه نظارت بر پرتونگاری هستهای استفاده میشود. شرکت سپهرگازکاویان تولید کننده و تامین کننده گازهای آزمایشگاهی مانند گاز هلیوم و مخلوط گازی ( تولید گازهای کالیبراسیون با تکیه بر اخذ گواهینامه Iso17025 همراه با سرتیفیکیت) با کیفیت و خلوص بالا و همچنین کالیبره کردن تمامی تجهیزات وابسته به صنایع مختلف فعال می باشد. همانگونه که میدانید گاز هلیوم یک گاز بی اثر و خنثی است و در آزمایشگاهها کاربردهای بسیاری دارد لذا از گرید های بالا(گاز هلیوم خلوص بالا)در آزمایشگاه ها استفاده میگردد.برای خرید گاز هلیوم با کارشناسان سپهرگاز کاویان تماس بگیرید. چرخ حمل سیلندر برای مسیر های صاف و پله رو ساخته میشود. چرخ حمل سیلندر یا چرخ دستی برای جابه جایی یک یا 4 سیلندر در مسیرهای کوتاه مورد استفاده است.پالت چهارچوبی است که برای حمل و جابجایی آسان سیلندرها مورد استفاده قرار می گیرد. سایز استاندارد پالت ها 6تایی،9تایی،12تایی،18تایی و 20تایی می باشد.برای خرید پالت حمل سیلندر گاز هلیوم با سپهرگازکاویان تماس بگیرید. 02146837950 گاز هلیوم در داروسازی به عنوان یک جایگزین مناسب برای اکسیژن استفاده میشود. اصلیترین کاربرد گاز هلیوم در داروسازی در زمینه آنستزیولوژی است، به خصوص در عملیات های جراحی. در جراحی های بزرگ و پیچیده، انتقال اکسیژن به بدن از اهمیت بسزایی برخوردار است. هلیوم به دلیل داشتن خواص فیزیکی خاص، میزان توزیع و حمل اکسیژن را به طور موثری افزایش میدهد. با استفاده از گاز هلیوم به جای اکسیژن در مرحله تهویه مصنوعی (ventilation)، تاثیر جراحی بر روی عملکرد ریه ها کاهش مییابد و تنفس بیشتری به بیمار تامین میشود. علاوه بر این، گاز هلیوم در دیگر بخشهای داروسازی نیز استفاده میشود. به عنوان مثال، در تولید محصولات دیگری مانند داروهای آئروسل (aerosol)، تست های تشخیصی (diagnostic tests) و همچنین برخی از داروهای تنفسی از گاز هلیوم استفاده میشود. کروماتوگرافی گازی(GC) یکی از روش های آنالیز مواد می باشد. گاز هلیوم به عنوان گاز حامل در دستگاه کروماتوگرافی گازی استفاده میشود.دستگاه GC یکی از روش ها برای جداسازی اجزای مواد می باشد.شیر گاز هلیوم با توجه رگولاتوری که به سیلندر متصل میشود به دو دسته ی رو پیچ و توپیچ تقسیم میشود. از آنجایی که این گاز گازی بی خطر بشمار میرود، کاربرد گستردهای در پر کردن بادکنکها دارد. بادکنکهای هلیومی به دلیل سبک بودن این گاز بالا رفته و در تزیینات مراسمها و جشنها طرفداران زیادی دارند. توجه : سپهر گاز کاویان در این زمینه هلیوم بادکنکی فعالیتی ندارد.
گاز هلیوم آزمایشگاهی

در سال 1895 آبراهام لانگلت و تئودور کلیو شیمیدان سوئدی هلیوم را شناسائی و از سنگ معدن کلویت که معدن اورانیوم است تولید کردند.
ادوارد فرانکلن “شیمیست انگلیسی" این عنصر را هلیوس نامگذاری نمود و چون انتظارداشت فلز باشد به آن پسوند ium- داد. ( بعدها با وجود مشخص شدن این نکته که گاز هلیوم یک عنصری غیر فلزی است اما نام آن تغییر نکرد ).
رادفورد و توماس رویدز در سال 1907 به اثبات رساندند که ذره های آلفا همان هسته ی هلیوم می باشند . این دو دانشمند با طیف سنجی گاز جمع آوری شده در اثر نفوذ ذره های آلفا در دیواره ی یک شیشه ی خالی به این نتیجه رسیدند.
گاز هلیوم کوچکترین عضو خانواده گازهای نجیب ( بی اثر) در جدول تناوبی است که با فرمول شیمیایی He و عدد اتمی ۲ نشان داده شده است.
گاز هلیوم دارای وزن اتمی 4.002602 gr/mol است.
گاز هلیوم گازی بی بو، بی رنگ، بی مزه، غیرسمّی و خنثی میباشد.
گاز هلیم از نظر کم واکنش پذیر بودن بعد از نئون دومین عنصر کم واکنش محسوب میگردد به گونه ای که در همه ی شرایط استاندارد بصورت تک اتمی باقی می ماند .
گاز هلیوم در مقایسه با گازهای تک اتمی از همه کمتر در آب حل میگردد و نسبت به گازهای دیگر یکی از کم حل شدنی ترین گازها میباشد.
دمای ذوب و جوش هلیوم در میان دیگر عنصرها بسیار پایین میباشد به همین دلیل در دمای اتاق و البته در بیشتر موارد به صورت گازی یافت میشوند مگر شرایط بسیار ویژهای بر آن اعمال گردد.
هلیوم دارای پایینترین نقطه ذوب ( نزدیک به صفر مطلق ) در میان عناصر میباشد و تنها مایعی است که با کاهش دما به جامد تبدیل نمیگردد و در فشار استاندارد تا دمای صفر مطلق به حالت مایع باقی میماند ؛ ( تنها با افزایش فشار میی توان آن را به جامد تبدیل نمود. )
در سال 1908 فیزیکدان هلندی هایک موفق گردید با رساندن دمای گازهلیوم به زیر یک کلوین هلیوم مایع تولید کند اما با توجه به اینکه هلیوم فاقد نقطه ی سه گانه ( دمائی که در آن هر سه فاز جامد ، مایع و گاز با هم در تعادل باشند ) است امکان ایجاد هلیوم جامد با کاهش دما میسر نمی باشد مگر با افزایش فشار که در سال 1926 ویلیام کیزوم با افزایش فشار بر یک سانتی متر مکعب گاز هلیوم آن را به جامد تبدیل کرد.
جرم مولی نسبتا پایین هلیوم سبب شده است که گاز هلیوم از رسانش گرمائی و ظرفیت گرمائی بالائی برخوردار باشد.
گاز هلیوم در حاکت گازی بعد از گاز هیدروژن از بالاترین سرعت صدا برخوردار است.تاریخچه گاز هلیوم
کاربرد گاز هلیوم
خواص شیمیایی و فیزیکی گاز هلیوم:
هلیوم وزن اتمی 4.002602 gr/mol را دارا میباشد.
گاز هلیوم گازی بی بو، بی رنگ، بی مزه، غیرسمّی و خنثی میباشد.
گاز هلیم از نظرواکنش پذیر بودن بعد از نئون دومین عنصر کم واکنش به شمار میآید به گونه ای که در همه ی شرایط استاندارد بصورت تک اتمی باقی می ماند .
گاز هلیوم در مقایسه با گازهای تک اتمی دیگر کمترین انحلال پذیری را دارد و نسبت به سایر گازها نیز از گازهای کم محلول به شمار میآید.
دمای ذوب و جوش هلیوم در میان عناصر دیگر بسیار کمتر میباشد. به همین دلیل در دمای اتاق و البته در بیشتر مواردحالت گازی دارد مگر شرایط بسیار خاصی بر آن تحمیل شود. هلیم در دما و فشار طبیعی حالت گازی تکاتمی دارد و فقط در شرایط بسیار غیر عادی دچار تراکم میشود. هلیم دارای پایینترین نقطه ذوب در میان عناصر میباشد و تنها مایعی است که با کاهش دما به جامد تبدیل نمیشود و در فشاراستاندارد تا دمای صفر مطلق به حالت مایع باقی میماند؛ (تنها با افزایش فشار میتوان آنرا به جامد تبدیل نمود.)
درحقیقت دمای بحرانی که بیشتراز آن بین حالات مایع و گاز هیچ تفاوتی وجود ندارد، تنها 19,5K است. He-4 و He-3 جامد از این نظر که یک محقق میتواند با استفاده از فشار حجم آنها را بیش از 30% تغییر دهد، منحصر به فرد هستند. ظرفیت گرمایی ویژه گاز هلیم بسیار زیاد است و بخار آن بسیار متراکم میباشد، بطوریکه در صورت گرم شدن در دمای اطاق سریعا" دچارانبساط میشود.
هلیم جامد فقط در فشار بالا و در تقریبا" 100 مگا پاسکال در 15- درجه کلوین است که بین دمای پایین و بالا یک جابجایی انجام میدهد که در آن ، اتمها دارای آرایشهای بهترتیب مکعبی و ششضلعی میشوند. در یک لحظه از این دما و فشار ، حالت سومی بوجود میآید که در آن ، اتمها آرایشی مکعبی به خود میگیرند، در حالیکه جرم آن در مرکز قرار دارد.
همه این حالتها از نظر انرژی و چگالی مشابه هستند و دلایل این تغییرات به جزئیات چگونگی شکلگیری اتمها بستگی دارد. گاز هلیوم دارای ویژگی های خاصی میباشد
کاربرد های گاز هلیوم
کاربردهای علمی گاز هلیوم
استفاده از هلیوم به دلیل ضریب شکست بسیار پایین، اثرات تحریف کننده تغییرات دما در فضای بین لنزها را در بعضی از تلسکوپها کم میکند این روش به خصوص در تلسکوپهای خورشیدی که در آن لوله تلسکوپ خلاء خیلی سنگین است مورد استفاده قرار میگیرد.کاربردهای پزشکی هلیوم
گاز هلیوم – اکسیژن برای تنفس در محیطهای پرفشار مثل لباس غواصی یا زیردریائیها کاربرد دارد، چون گازهلیوم ساکن میباشد و کمتر از نیتروژن، در خون قابل حل است و 2,5 مرتبه سریعتر از نیتروژن انتشار میابد. این مسئله باعث کاهش مدت زمان لازم برای از بین بردن گاز در هنگام فشارزدایی میشود و خطر خواب نیتروژنی را از بین میبرد و احتمال تمرکز آن مثل حبابهای متصل وجود ندارد.استفاده از گاز هلیوم در جوشکاری
مصرف هلیوم برای غواصان
نقش هلیوم در ماشین سازی

خطرات و نکات ایمنی گاز هلیوم
تنفس هلیوم
سوختگی و انفجار هلیوم
خطر هلیوم مایع
تنفس هلیوم
اثرات گاز هلیوم بر سلامت انسان
اثرات گاز هلیوم بر محیط زیست
قیمت گاز هلیوم
02146835980قیمت گاز هلیوم وارداتی
قیمت خرید گاز هلیوم
قیمت خرید اینترنتی کپسول گاز هلیوم
sale@kaviangas.irقیمت گاز هلیوم در تهران و البرز
02146835980قیمت گاز هلیوم خالص آزمایشگاهی
قیمت گاز هلیوم خالص با سرتیفیکیت معتبر
قیمت شارژ گاز هلیوم:
قیمت شیر کپسول
قیمت میکس گاز هلیوم
قیمت دتکتور گاز هلیوم:
قیمت سیلندر فولادی گاز هلیوم
خرید گاز هلیوم
خرید هلیوم خالص
خرید گاز وارداتی هلیوم
خرید گاز هلیوم با کیفیت
خرید گاز هلیوم آزمایشگاهی
خرید چرخ حمل و پالت سیلندر گاز هلیوم
02146835980خرید هلیوم در دستگاه GC و شیر سیلندر
فروش گاز هلیوم بادکنک
نحوه سفارش گذاری
انتخاب محصول
ثبت سفارش
دریافت محصول






